|
تضامنًا مع حق الشعب الفلسطيني |
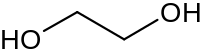
إيثيلين غليكول
| إيثيلين غليكول | |
|---|---|
 |
 |
| الاسم النظامي (IUPAC) | |
Ethane-1,2-diol |
|
| أسماء أخرى | |
Ethylene glycol 1,2-EthanediolGlycol |
|
| المعرفات | |
| الاختصارات | MEG |
| رقم CAS | 107-21-1 104700-12-1 (13C2) 59609-67-5 (14C2) 2219-52-5 (2H),(2H) |
| بوب كيم (PubChem) | 174 ? 21334931 ? 16213434 ? 134462 ? 10986148 ? |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
|
|
| الخواص | |
| صيغة كيميائية | C2H6O2 |
| كتلة مولية | 62.07 غ.مول−1 |
| المظهر | سائل شفاف عديم اللون |
| الكثافة | 1.1132 غ/سم3 |
| نقطة الانصهار | −12.9 °س، 260 °ك، 9 °ف |
| نقطة الغليان | 197.3 °س، 470 °ك، 387 °ف |
| الذوبانية في الماء | امتزاجية |
| الذوبانية | يذوب في معظم المذيبات العضوية |
| اللزوجة | 1.61 × 10−2 نيوتن·ثانية / متر2[1] |
| المخاطر | |
| صحيفة بيانات سلامة المادة | صحيفة بيانات خارجية |
| ترميز المخاطر | مؤذي (Xn) |
| توصيف المخاطر | |
| تحذيرات وقائية | |
| مخاطر | مؤذي جداً للحيوانات الأليفة والأطفال، في حالة تناوله يجب التوجه إلى الرعاية الطبية فوراً. |
| NFPA 704 |
|
| نقطة الوميض | 111 °س (231.8 °ك) (كأس مغلقة) |
| درجة حرارة الاشتعال الذاتي |
410 °س (770 °ك) |
| مركبات متعلقة | |
| ديول ذات علاقة | بروبيلين غليكول غلايكول ثنائي الايثيلين غليكول ثلاثي الإثيلين بولي إيثيلين جلايكول |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
إيثيلين جليكول الصيغة الجزيئية: C2H4(OH)2. يحضر عن طريق تفاعل أكسيد الإيثيلين مع الماء كما في المعادلة التالية: C2H4O + H2O → HO–CH2CH2–OH
استخداماتها
- إذابة الجليد في البلاد الباردة.
- مانع تجمد يضاف لماء رديتر السيارات.
- تستخدم في صناعة بعض معاجين الأسنان المزيفة.
إنتاجه في الطبيعة
بالرغم أن إنتاج إيثيلين غليكول يتم صناعيا، إلا أن يسروع (يرقة) جالاريا ميلونيلا التي تقتات على شمع النحل، تستطيع بمساعدة إنزيم أو بكتيريا في جهازها الهضمي تحليل البولي إثيلين (بلاستيك شائع) (PE) إلى إثيلين غليكول.[2][3][4]
التسمم بالجليكولات
يحدث التسمم بالجليكولات عادة بسبب تعاطي هذه المشروبات من قِبَل معتادي الشراب كبديل للمشروبات الكحولية، أو عن طريق الخطأ لتشابههما الكبير في الصفات الطبيعية والرائحة. وكلا المركبين يتحولان في الجسم إلى حمض الأوكساليك.
أعراض التسمم بالجليكولات
تتشابه الأعراض المبدئية إلى حدٍ بعيد مع أعراض تعاطي المشروبات الكحولية، ثم تتدرج إلى حالة قيء شديد وتشنجات ثم فقدان للوعي وغيبوبة مصحوبة بانعدام الأفعال المنعكسة واختلاجات مع سرعة في معدل التنفس والنبض وانخفاض في درجة الحرارة. وتحدث الوفاة كنتيجة لفشل التنفس في خلال بضع ساعات، أو كنتيجة لودمة رئوية في خلال يوم أو يومين، أو خلال عدة أيام بسبب تنخر الكبد والكلى.
علاج التسمم بالجليكولات
في الساعتين الأولتين من التعاطي يمكن غسل المعدة للتخلص من الكميات المتعاطاة من الجليكولات. ويعتمد العلاج أساساً على إعطاء المريض كميات كبيرة من محلول بيكربونات الصوديوم مع متابعة التوازن الحمضي القاعدي للدم بالمختبر. ويفيد الديال الدموي (hemodialysis) في التخلص الفعال من الجليكولات بالدم وخاصة إذا كانت الأعراض شديدة ومستوى الدم أكثر من 50 مج% (في حالة الإيثيلين جليكول). وتستغل خاصية التثبيط التنافسي للإيثانول على استقلاب الإيثيلين جليكول في تأخير استقلاب الأخير، حيث يُعطى الإيثانول بالوريد (بجرعة قدرها 7,6-10 مل/كجم في 5% جلوكوز وعلى مدى 30 دقيقة كجرعة أولية، ثم تُتبع بجرعة 1,39 مل/كجم/ساعة)، أو يعطى الإيثانول 40% بالفم (بجرعة 1,5- 2 مل/كجم في عصير برتقال وعلى مدى 30 دقيقة كجرعة أولية، ثم تُتبع بجرعة 0,29 مل/كجم/ساعة)، وتزداد هذه الجرعات في حالة إعطاء الإيثانول بمصاحبة الديال، ويستمر إعطاء الإيثانول لمدة لا تقل عن 3 أيام في حالة عدم إعطائه مع الديال ولمدة لا تقل عن يوم واحد عند إعطائه مع الديال، وبغرض أن لا يزيد مستوى الإيثانول في الدم عن 100 مجم%. كما يمكن العلاج باستخدام (4-methyl pyrazole) الذي يساعد على تثبيط إنزيم نازع هيدروجين الكحول فيمنع تكوين حمضي الأوكساليك والفورميك. كذلك يفضل استخدام الثيامين والبيريدوكسين اللذين يساعدان على تحويل حمض الجليوكساليك (وهو أحد نواتج استقلاب الإيثيلين جليكول) إلى نواتج غير سامة. هذا بالإضافة إلى العلاج الدعمي حسب احتياجات المريض
مراجع
- ^ Elert، Glenn. "Viscosity". The Physics Hypertextbook. مؤرشف من الأصل في 2009-09-17. اطلع عليه بتاريخ 2007-10-02.
- ^ Yang، Jun؛ Yang، Yu؛ Wu، Wei-Min؛ Zhao، Jiao؛ Jiang، Lei (2 ديسمبر 2014). "Evidence of polyethylene biodegradation by bacterial strains from the guts of plastic-eating waxworms". Environmental Science & Technology. ج. 48 ع. 23: 13776–13784. DOI:10.1021/es504038a. ISSN:1520-5851. PMID:25384056. مؤرشف من الأصل في 2019-02-18.
- ^ Bombelli, Paolo; Howe, Christopher J.; Bertocchini, Federica (24 Apr 2017). "Polyethylene bio-degradation by caterpillars of the wax moth Galleria mellonella". Current Biology (بالإنجليزية). 27 (8): R292–R293. DOI:10.1016/j.cub.2017.02.060. ISSN:0960-9822. Archived from the original on 2019-08-30.
- ^ Khan، Amina (24 أبريل 2017). "Stubborn plastic may have finally met its match: the hungry wax worm". Los Angeles Times. مؤرشف من الأصل في 2018-05-01. اطلع عليه بتاريخ 2017-04-25.
| إيثيلين غليكول في المشاريع الشقيقة: | |