|
تضامنًا مع حق الشعب الفلسطيني |
أسيتيلين
| أسيتيلين | |
|---|---|
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل |
الأسيتلين[1] (أسيتيلين، إيثاين، إسيتيلين) (بالإنجليزية: Acetylene) هو هيدروكربون يتبع مجموعة الألكاينات.[2][3][4] يعتبر الأسيتلين أبسط الألكاينات حيث يتكون من ذرتي هيدروجين وذرتي كربون مرتبطين برابطة ثلاثية.
و أيضا يستخدم هذا الغاز عديم اللون (الهيدروكربونات المنخفضة بشكل عام غازية بطبيعتها) على نطاق واسع كوقود وكتلة بناء كيميائية. إنه غير مستقر في شكله النقي، وبالتالي عادة ما يتم التعامل معه كحل. الأسيتيلين النقي عديم الرائحة، لكن الدرجات التجارية عادة ما يكون لها رائحة ملحوظة بسبب الشوائب.[5]
بصفته ألكاين، فإن الأسيتيلين غير مشبع لأن ذرتين من الكربون مرتبطان معًا في رابطة ثلاثية. تضع الرابطة الثلاثية للكربون والكربون جميع الذرات الأربع في نفس الخط المستقيم، بزوايا رابطة CCH تبلغ 180 درجة[6]
اكتشافه
تم اكتشاف الأسيتيلين في عام 1836 من قبل إدموند ديفي، الذي حدده بأنه «مكربن جديد من الهيدروجين». كان اكتشافًا عرضيًا أثناء محاولة عزل معدن البوتاسيوم. من خلال تسخين كربونات البوتاسيوم بالكربون في درجات حرارة عالية جدًا، أنتج بقايا لما يعرف الآن باسم كربيد البوتاسيوم (K2C2)، والتي تتفاعل مع الماء لإطلاق الغاز الجديد. أعيد اكتشافه في عام 1860 من قبل الكيميائي الفرنسي مارسيلين بيرثيلو، الذي صاغ اسم أستلين. كانت صيغة Berthelot التجريبية للأسيتيلين (C4H2)، بالإضافة إلى الاسم البديل "quadricarbure d'hydrogène" (رباعي كربيد الهيدروجين)، غير صحيحة لأن الكيميائيين في ذلك الوقت استخدموا الكتلة الذرية الخاطئة للكربون (6 بدلاً من 12). [بحاجة لمصدر] كان Berthelot قادرًا على تحضير هذا الغاز عن طريق تمرير أبخرة المركبات العضوية (الميثانول والإيثانول وما إلى ذلك) عبر أنبوب أحمر ساخن وجمع النفايات السائلة. ووجد أيضًا أن الأسيتيلين يتكون عن طريق توليد الكهرباء من خلال غازات السيانوجين والهيدروجين المختلطة. حصل Berthelot لاحقًا على الأسيتيلين مباشرة عن طريق تمرير الهيدروجين بين أقطاب قوس الكربون. قد يحمل غاز الأسيتيلين المتاح تجارياً الروائح من الشوائب كبريتيد الديفينيل والفوسفين.[7]
تحضيره
منذ الخمسينيات من القرن الماضي، تم تصنيع الأسيتيلين بشكل أساسي عن طريق الاحتراق الجزئي للميثان. إنه منتج جانبي مسترجع في إنتاج الإيثيلين عن طريق تكسير الهيدروكربونات. تم إنتاج ما يقرب من 400000 طن من خلال هذه الطريقة في عام 1983. وجودها في الإيثيلين عادة ما يكون غير مرغوب فيه بسبب طابعه المتفجر وقدرته على تسميم محفزات زيجلر-ناتا. يتم هدرجة انتقائيًا إلى إيثيلين، عادةً باستخدام محفزات Pd – Ag.[8]
حتى الخمسينيات من القرن الماضي، عندما حل النفط محل الفحم كمصدر رئيسي لتخفيض الكربون، كان الأسيتيلين (والجزء العطري من قطران الفحم) هو المصدر الرئيسي للمواد الكيميائية العضوية في الصناعة الكيميائية. تم تحضيره عن طريق التحلل المائي لكربيد الكالسيوم، وهو تفاعل اكتشفه فريدريك فولر[9] في عام 1862 ولا يزال مألوفًا للطلاب:
CaC2 + 2H2O → Ca(OH)2 + C2H2
يتطلب إنتاج كربيد الكالسيوم درجات حرارة عالية للغاية، ~ 2000 درجة مئوية، مما يستلزم استخدام فرن القوس الكهربائي. في الولايات المتحدة، كانت هذه العملية جزءًا مهمًا من ثورة الكيمياء في أواخر القرن التاسع عشر التي أتاحها مشروع الطاقة الكهرومائية الضخم في شلالات نياجرا.
الرابطة
من حيث نظرية رابطة التكافؤ، في كل ذرة كربون، يتم تهجين المدار 2s مع مداري 2p وبالتالي تشكيل sp هجين. يظل المداران الآخران 2p غير مهجنين. يتداخل طرفا المداري الهجين sp لتكوين رابطة تكافؤ قوية بين الكربون، بينما تلتصق ذرات الهيدروجين في كل من الطرفين الآخرين أيضًا بواسطة روابط. يشكل المدارات 2p غير المتغيرة زوجًا من الروابط الأضعف.[10]
نظرًا لأن الأسيتيلين عبارة عن جزيء خطي متماثل، فإنه يمتلك مجموعة نقاط D∞h.
الخصائص الفيزيائية
تغييرات الحالة
عند الضغط الجوي، لا يمكن أن يوجد الأسيتيلين في صورة سائل وليس له نقطة انصهار. تتوافق النقطة الثلاثية في مخطط الطور مع نقطة الانصهار (80.8 درجة مئوية) عند أدنى ضغط يمكن أن يوجد عنده الأسيتيلين السائل (1.27 ضغط جوي). عند درجات حرارة أقل من النقطة الثلاثية، يمكن أن يتغير الأسيتيلين الصلب مباشرة إلى البخار (الغاز) عن طريق التسامي. نقطة التسامي عند الضغط الجوي هي -84.0 درجة مئوية.[11]
أخري
في درجة حرارة الغرفة، تبلغ قابلية ذوبان الأسيتيلين في الأسيتون 27.9 جم لكل كجم. لنفس الكمية من ثنائي ميثيل فورماميد (DMF)، تكون القابلية للذوبان 51 جم. عند 20.26 بار، تزداد قابلية الذوبان إلى 689.0 و 628.0 جم للأسيتون و DMF ، على التوالي. تستخدم هذه المذيبات في اسطوانات الغاز المضغوط.
التطبيقات
يستخدم الأستيلين مع الأكسجين لإنتاج حرارة عالية للتلحيم وفي تصنيع المواد الكيميائية الصناعية مثل كلوريد الفينيل، والأكريلونتريل acrylonitrile ، والبولي فينيل بيروليدون polyvinylpyrrolidone ، وثلاثي كلور الإيثيلين trichloroethylene ، وتصنع على الأغلب مادة كيميائية واحدة فقط من الأسيتيلين: الكلوربرين chloroprene وبلمرة النيوبرين polymer neoprene . إن دراسات الضغوط العالية (تقنية ريب Reppe ذات الضغط العالي) مهمة جداً في كون تفاعلات الفنيلة vinylation ، والأثنلة ethynylation، والبلمرة polymerization قد هيأت حقلاً جديداً للكيمياء بإدخالها كثيراً من المركبات الجديدة.
اللحام
يتم توفير ما يقرب من 20 ٪ من الأسيتيلين من قبل صناعة الغازات الصناعية من أجل اللحام والقطع بغاز أوكسي أسيتيلين بسبب ارتفاع درجة حرارة اللهب. ينتج عن احتراق الأسيتيلين بالأكسجين لهبًا يزيد عن 3600 كلفن (3330 درجة مئوية، 6020 درجة فهرنهايت)، ويطلق 11.8 كيلو جول / جم. أوكسي أسيتيلين هو غاز الوقود الشائع الأكثر حرقًا. الأسيتيلين هو ثالث اللهب الكيميائي الطبيعي سخونة بعد 5,260 كلفن (4,990 درجة مئوية، 9010 درجة فهرنهايت) والسيانوجين عند 4,798 كلفن (4525 درجة مئوية، 8,177 درجة فهرنهايت).[12] كان لحام الأكسجين والأسيتيلين عملية لحام شائعة في العقود السابقة. أدى تطوير ومزايا عمليات اللحام القائمة على القوس إلى جعل اللحام بالوقود الأكسجينى شبه منقرض للعديد من التطبيقات. انخفض استخدام الأسيتيلين في اللحام بشكل كبير. من ناحية أخرى، فإن معدات اللحام بالأكسجين والأسيتيلين متعددة الاستخدامات - ليس فقط لأن الشعلة مفضلة لبعض أنواع اللحام بالحديد أو الفولاذ (كما هو الحال في بعض التطبيقات الفنية)، ولكن أيضًا لأنها تتناسب بسهولة مع اللحام بالنحاس واللحام بالنحاس، تسخين المعادن (للتلدين أو التقسية، الانحناء أو التشكيل)، فك الصواميل والمسامير المتآكلة، وغيرها من التطبيقات. لا يزال فنيو إصلاح الكابلات في Bell Canada يستخدمون أطقم الشعلة المحمولة التي تعمل بوقود الأسيتيلين كأداة لحام لإغلاق وصلات جلبة الرصاص في فتحات التفتيش وفي بعض المواقع الجوية. يمكن أيضًا استخدام اللحام بالأوكسي أسيتيلين في المناطق التي لا يمكن الوصول إلى الكهرباء فيها بسهولة. يستخدم قطع الأكسجين والأسيتيلين في العديد من محلات تصنيع المعادن. للاستخدام في اللحام والقطع، يجب التحكم في ضغوط العمل بواسطة منظم، نظرًا لأن فوق 15 رطلًا لكل بوصة مربعة (100 كيلو باسكال)، إذا تعرضت لموجة صدمة (ناتجة، على سبيل المثال، عن طريق الفلاش باك)، يتحلل الأسيتيلين بشكل متفجر إلى هيدروجين وكربون.[13]
الأضاءة المحمولة
تم استخدام كربيد الكالسيوم لتوليد الأسيتيلين المستخدم في المصابيح للتطبيقات المحمولة أو البعيدة. تم استخدامه لعمال المناجم والكهوف قبل انتشار استخدام الإضاءة المتوهجة؛ أو بعد عدة سنوات إضاءة LED منخفضة الطاقة / عالية التجويف؛ وما زالت تستخدم من قبل صناعات التعدين في بعض الدول بدون قوانين السلامة في مكان العمل. كما تم استخدام مصابيح الكربيد على نطاق واسع كمصابيح أمامية في السيارات القديمة وكمصدر مبكر للضوء للمنارات.
مشتقات البلاستيك وحمض الأكريليك
باستثناء الصين، انخفض استخدام الأسيتيلين كمادة وسيطة كيميائية بنسبة 70٪ من عام 1965 إلى عام 2007 بسبب التكلفة والاعتبارات البيئية. يمكن تحويل الأسيتيلين إلى مادة شبه مهدرجة إلى إيثيلين، مما يوفر مادة أولية لمجموعة متنوعة من بلاستيك البولي إيثيلين. من التطبيقات الرئيسية الأخرى للأسيتيلين، خاصة في الصين، تحويله إلى مشتقات حمض الأكريليك. تشكل هذه المشتقات منتجات مثل ألياف الأكريليك والنظارات والدهانات والراتنجات والبوليمرات.[14]
تفاعلات
Vinylation: الماء، الهلجنة المائية، والتفاعلات ذات الصلة
في تفاعلات vinylation ، تضيف مركبات HX عبر الرابطة الثلاثية. تضاف الكحولات والفينولات إلى الأسيتيلين لإعطاء إثيرات الفينيل. يعطي الثيول ثيوثيرات الفينيل. وبالمثل، يتم إنتاج فينيل بيروليدون وفينيل كاربازول صناعياً عن طريق فينيل 2-بيروليدون وكاربازول[15]

ترطيب الأسيتيلين هو تفاعل تبخير، ولكن يتحول كحول الفينيل الناتج إلى أسيتالديهيد. يتم تحفيز التفاعل بواسطة أملاح الزئبق. كان هذا التفاعل في السابق هو التقنية السائدة لإنتاج الأسيتالديهيد، ولكن تم استبداله بواسطة عملية Wacker ، التي توفر الأسيتالديهيد عن طريق أكسدة الإيثيلين، وهو مادة وسيطة أرخص. ينطبق موقف مشابه على تحويل الأسيتيلين إلى كلوريد الفينيل القيم عن طريق الكلورة الهيدروكلورية مقابل الكلورة المؤكسدة للإيثيلين.
إضافة إلى الفورمالديهايد

يضاف الأسيتيلين إلى الكيتونات والألدهيدات في وجود محفزات قاعدية. مع مجموعات الكربونيل لإعطاء كحول ألفا إيثينيل في تفاعلات إيثينيل: يعطي الفورمالديهايد كحول بروبارجيل وبوتينيديول بالتتابع. يتم إنتاج 1.4-بوتينيديول صناعيًا بهذه الطريقة من الفورمالديهايد والأسيتيلين
الكيمياء العضوية المعدنية
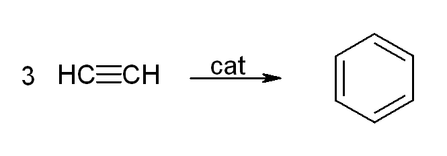
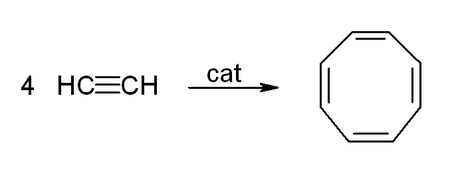
يشكل الأسيتيلين ومشتقاته (2-بوتين، ثنائي فينيل أسيتيلين، إلخ) معقدات مع معادن انتقالية. يشبه ارتباطه بالمعدن إلى حد ما ارتباط معقدات الإيثيلين. هذه المجمعات عبارة عن مركبات وسيطة في العديد من التفاعلات التحفيزية مثل تقليم ألكين للبنزين، و tetramerization إلى cyclooctatetraene ، و carbonylation إلى hydroquinone[16]
إجراءات السلامة
المخاطر الصحية
يؤثر غاز الأستيلين على الصحة عند استنشاقه. وقد يسبب الدوار وعدم الاتزان وكذلك فقدان الوعي. والتعرض لهذا الغاز بدرجة كبيرة يقلل من كمية الأكسجين في الهواء وقد يسبب الاختناق والموت.
قابلية الاشتعال والتفاعل الكيميائي
قابل للاشتعال بدرجة كبيرة ومادة كيميائية متفاعلة. عرضة لخطر الانفجار والحريق. تتفاعل على نحو متفجر مع المعادن الثقيلة وأملاحها والعوامل المؤكسدة والأوزون والأكسجين.
التخزين
يجب تخزينها تحت ضغط وإضافة مادة كيميائية لحفظ خصائصها وذلك في مكان بارد وجيد التهوية بعيداً عن الحرارة أو الشرر أو اللهب. يحظر استخدام مصادر الإشعال في مكان استخدام الأستيلين أو حمل هذه المصادر أو تخزينها معها. يجب ربط نظام الأنابيب كهربائياً وتوصيله بالأرضي أينما تم استخدام غاز الأستيلين أو التعامل معه أو تخزينه أو استخدام معدات كهربائية وتجهيزات مقاومة للانفجار. لا تستخدم إلا الأدوات والمعدات غير المحدثة للشرر خاصة عند فتح أسطوانة غاز الأستيلين وإغلاقها. يحظر استخدام مصادر الإشعال في مكان استخدام الأستيلين أو حمل هذه المصادر أو تخزينها معها. النقل: أسطوانات. التسرب: قم بإخلاء المنطقة الخطرة! استشر خبير! التهوية (حماية شخصية إضافية: جهاز التنفس الذاتي) التخلص منه: التهوية. معدات الحماية الشخصية (المهمات): ارتدي قفازات وملابس وقائية. ارتدي ملابس الوقاية المصنوعة من مادة لا تولد تياراً كهربائياً. فقد يحل هذا الغاز محل الأكسجين ويؤدي للاختناق. استخدم جهاز التنفس الذاتي في حالة نقص الأكسجين من الهواء.
الاستنشاق
نقل الشخص بعيداً عن منطقة تعرضه للغاز، والبدء بمساعدته على التنفس في حالة توقف التنفس. الإسعافات الأولية ملامسة العين أو الجلد: تجنب ملامسة الأستيلين للجلد. فوراً اغسل بكمية وفيرة من الماء لمدة لا تقل عن 15 دقيقة. استبعد الملابس الملوثة فوراً واغسل المنطقة المصابة بكمية وفيرة من الماء. الإشعال: لا ينطبق.
الاستخدامات
يستخدم في عملية لحم المعادن.
| في كومنز صور وملفات عن: أسيتيلين |
اقرأ أيضاً
مراجع
- ^ Q113378673، ص. 10، QID:Q113378673
- ^ "Lighthouse Lamps Through Time by Thomas Tag | US Lighthouse Society". uslhs.org (بEnglish). Archived from the original on 2018-01-01. Retrieved 2017-02-24.
- ^ Acyclic Hydrocarbons. Rule A-3. Unsaturated Compounds and Univalent Radicals, IUPAC Nomenclature of Organic Chemistry نسخة محفوظة 10 أكتوبر 2000 على موقع واي باك مشين.
- ^ Downie، N. A. (1997). Industrial Gases. London; New York: Blackie Academic & Professional. ISBN:978-0-7514-0352-7.
- ^ Compressed Gas Association (1995) Material Safety and Data Sheet – Acetylene نسخة محفوظة 11 July 2012 على موقع واي باك مشين.
- ^ Whitten K. W., Gailey K. D. and Davis R. E. General Chemistry (4th ed., Saunders College Publishing 1992), p. 328–329, 1046. (ردمك 0-03-072373-6).
- ^ Berthelot (1862) "Synthèse de l'acétylène par la combinaison directe du carbone avec l'hydrogène" (Synthesis of acetylene by the direct combination of carbon with hydrogen), Comptes rendus, series 3, 54 : 640–644. نسخة محفوظة 14 أغسطس 2020 على موقع واي باك مشين.
- ^ Acetylene: How Products are Made نسخة محفوظة 20 January 2007 على موقع واي باك مشين.
- ^ Wohler (1862) "Bildung des Acetylens durch Kohlenstoffcalcium" (Formation of actylene by calcium carbide), Annalen der Chemie und Pharmacie, 124 : 220. نسخة محفوظة 4 ديسمبر 2020 على موقع واي باك مشين.
- ^ Organic Chemistry 7th ed. by J. McMurry, Thomson 2008
- ^ Handbook of Chemistry and Physics (60th ed., CRC Press 1979–80), p. C-303 in Table Physical Constants of Organic Compounds (listed as ethyne).
- ^ "Acetylene". Products and Supply > Fuel Gases. Linde. مؤرشف من الأصل في 2018-01-12. اطلع عليه بتاريخ 2013-11-30.
- ^ ESAB Oxy-acetylene welding handbook – Acetylene properties. نسخة محفوظة 10 مايو 2020 على موقع واي باك مشين.
- ^ Acrylic Acid and Derivatives - Ohara - - Major Reference Works - Wiley Online Library نسخة محفوظة 6 نوفمبر 2020 على موقع واي باك مشين.
- ^ Pässler، Peter؛ Hefner، Werner؛ Buckl، Klaus؛ Meinass، Helmut؛ Meiswinkel، Andreas؛ Wernicke، Hans-Jürgen؛ Ebersberg، Günter؛ Müller، Richard؛ Bässler (2005)، "Acetylene Chemistry"، موسوعة أولمان للكيمياء الصناعية، فاينهايم: وايلي-في سي إتش، DOI:10.1002/14356007.a01_097.pub3
- ^ Reppe, Walter; Kutepow, N; Magin, A (1969). "Cyclization of Acetylenic Compounds". Angewandte Chemie International Edition in English. 8 (10): 727–733. doi:10.1002/anie.196907271.
