|
تضامنًا مع حق الشعب الفلسطيني |
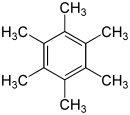
سداسي ميثيل البنزين
| سداسي ميثيل البنزين | |
|---|---|
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
Hexamethylbenzene |
|
| أسماء أخرى | |
1,2,3,4,5,6-Hexamethylbenzene |
|
| الخواص | |
| الصيغة الجزيئية | C12H18 |
| الكتلة المولية | 162.28 غ/مول |
| المظهر | صلب بلوري أبيض |
| الكثافة | 1.04 غ/سم3 |
| نقطة الانصهار | 165 °س |
| نقطة الغليان | 263 °س |
| الذوبانية في الماء | غير منحل |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
سداسي ميثيل البنزين هو مركب عضوي هيدروكربوني عطري صيغته الكيميائية C12H18، ويوجد في الشروط القياسية على شكل صلب بلوري أبيض اللون.
التحضير
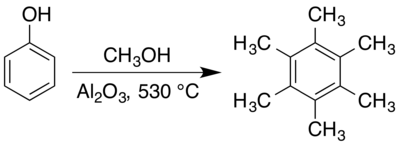
يحضر المركب من تفاعل الفينول في الميثانول فوق حفاز نشط من أكسيد الألومنيوم (الألومينا) عند درجات حرارة تصل إلى 530 °س.[1][2]
الخواص
يوجد المركب في الشروط القياسية على شكل بلورات بيضاء اللون، وهي غير قابلة للانحلال في الماء. تستطيع المؤكسدات القوية أن تؤكسد سداسي ميثيل البنزين إلى حمض الميليتيك.

استطاعت كاثلين لونسدال سنة 1929 أن تدرس البنية البلورية لهذا المركب بواسطة الأشعة السينية.[3]
الاستخدامات
يستخدم المركب بشكل واسع ربيطةً في مجال الكيمياء العضوية الفلزية،[4] حيث يشكل معقدات تناسقية مع عدد من الفلزات الانتقالية مثل الكوبالت،[5] والكروم،[6] والحديد،[7] والرينيوم،[8] والروثينيوم،[9] والنيتانيوم.[10]
يستخدم المركب أيضاً في مجال مطيافية الرنين المغناطيسي النووي العاملة بنظير الهيليوم-3.[11]
طالع أيضاً
مراجع
- ^ Phillip S. Landis, Werner O. Haag: "Formation of Hexamethylbenzene from Phenol and Methanol", in: The Journal of Organic Chemistry, 1963, 28 (2), S. 585–585; doi:10.1021/jo01037a517.
- ^ N. M. Cullinane, S. J. Chard, C. W. C. Dawkins: Hexamethylbenzene In: Organic Syntheses. 35, 1955, S. 73, doi:10.15227/orgsyn.035.0073; Coll. Vol. 4, 1963, S. 520
- ^ Lonsdale، Kathleen (1928). "The Structure of the Benzene Ring". Nature. ج. 122 ع. 810: 810. DOI:10.1038/122810c0.
- ^ Pampaloni، Guido (2010). "Aromatic hydrocarbons as ligands. Recent advances in the synthesis, the reactivity and the applications of bis(η6-arene) complexes". Coord. Chem. Rev. ج. 254 ع. 5–6: 402–419. DOI:10.1016/j.ccr.2009.05.014.
- ^ Fischer, Ernst Otto; Lindner, Hans Hasso (1964). "Über Aromatenkomplexe von Metallen. LXXVI. Di-hexamethylbenzol-metall-π-komplexe des ein- und zweiwertigen Kobalts und Rhodiums" [About Aromatic Complexes of Metals. LXXVI. Di-hexamethylbenzene metal-π-complexes of mono- and bivalent cobalt and rhodium]. J. Organomet. Chem. (بالألمانية). 1 (4): 307–317. DOI:10.1016/S0022-328X(00)80056-X.
- ^ Zeiss، H. H.؛ Herwig، W. (1958). "Acetylenic π-complexes of chromium in organic synthesis". J. Am. Chem. Soc. ج. 80 ع. 11: 2913. DOI:10.1021/ja01544a091.
- ^ Kotz، John C. (1986). "The Electrochemistry of Transition Metal Organometallic Compounds". في Fry، Albert J.؛ Britton، Wayne E. (المحررون). Topics in Organic Electrochemistry. Springer Science & Business Media. ص. 83–176. ISBN:9781489920348.
- ^ Fischer، Ernst Otto؛ Schmidt، Manfred W. (1966). "Über Aromatenkomplexe von Metallen, XCI. Über monomeres und dimeres Bis-hexamethylbenzol-rhenium". Chem. Ber. ج. 99 ع. 7: 2206–2212. DOI:10.1002/cber.19660990719.
- ^ Huttner، Gottfried؛ Lange، Siegfried؛ Fischer، Ernst O. (1971). "Molecular Structure of Bis(Hexamethylbenzene)Ruthenium(0)". Angew. Chem. Int. Ed. Engl. ج. 10 ع. 8: 556–557. DOI:10.1002/anie.197105561.
- ^ Franzus، B.؛ Canterino، P. J.؛ Wickliffe، R. A. (1959). "Titanium tetrachloride–trialkylaluminum complex—A cyclizing catalyst for acetylenic compounds". J. Am. Chem. Soc. ج. 81 ع. 6: 1514. DOI:10.1021/ja01515a061.
- ^ Saunders، Martin؛ Jiménez-Vázquez، Hugo A.؛ Khong، Anthony (1996). "NMR of 3He Dissolved in Organic Solids". J. Phys. Chem. ج. 100 ع. 39: 15968–15971. DOI:10.1021/jp9617783.
| سداسي ميثيل البنزين في المشاريع الشقيقة: | |