|
تضامنًا مع حق الشعب الفلسطيني |
يوريا
| يوريا | |
|---|---|
 |
 |
| الاسم النظامي (IUPAC) | |
Diaminomethanal (مركب عضوي)، |
|
| أسماء أخرى | |
كارباميد، |
|
| المعرفات | |
| رقم CAS | 57-13-6? |
| بوب كيم (PubChem) | 1176 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| صيغة كيميائية | CH4N2O |
| كتلة مولية | 60.06 غ.مول−1 |
| المظهر | صلب أبيض |
| الكثافة | 1.32 غ/سم3 |
| نقطة الانصهار | 132.7–135 °م |
| الذوبانية في الماء | 108 غ/100 مل (20 °م) 167 غ/100 مل (40 °م) 251 غ/100 مل (60 °م) 400 غ/100 مل (80 °م) 733 غ/100 مل (100 °م) |
| القاعدية (pKb) | pKBH+ = 0.18[1] |
| البنية | |
| عزم جزيئي ثنائي القطب | 4.56 ديباي |
| المخاطر | |
| صحيفة بيانات سلامة المادة | JT Baker |
| فهرس المفوضية الأوروبية | غير موجود |
| نقطة الوميض | غير مشتعل |
| مركبات متعلقة | |
| يوريا ذات علاقة | ثيويوريا كارباميد بيروكسيد |
| مركبات ذات علاقة | فوق أكسيد الكرباميد فوسفات اليوريا |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
الكَرْبامِيد (بالإنجليزية: carbamide) أو اليُوْرِيا[2] أو البَوْلَة (بالإنجليزية: urea) في الكيمياء والكيمياء الحيوية هي مركب عضوي صيغته الكيميائية CO(NH2)2. اسم الكارباميد موصى به في الأسماء غير الاحتكارية العالمية والمستخدم في أوروبا. كمثال: المركب بيروكسيد الهيدروجين - يوريا Hydrogen peroxide - urea (الاسم المصدق عليه قديمًا في إنجلترا) أصبح الآن يستخدم في الأوساط الطبية كـ كرباميد بيروكسيدcarbamide peroxide ويستخدم في تبييض الأسنان. من الأسماء الأخرى راتنج الكرباميد (بالإنجليزية: carbamide resin)، إيزويوريا، ثنائي أميد الكربونيل (بالإنجليزية: carbonyl diamide)، ثنائي أميد الكربونيل (بالإنجليزية: carbonyldiamine).
تنتج هذه المادّة لدى الكثير من الحيوانات، كمركّب نهائي لعمليّة استقلاب المركّبات الآزوتيّة (كالحموض الأمينيّة مثلاً) في دورة الكرباميد التي تحدث في الكبد، وتُطرد من الجسم عن طريق البول والعرق.
الكرباميد الصافي مادّة بلورية بيضاء رائحتها قريبة من رائحة النشادر، غير سامّة وحتّى نظافيًّا غير ضارّة. اليوريا النقية تكون بيضاء اللون في شكل بلورات،عديمة الرائحة، غير سامة، وتعتبر طاهرة، تذوب بسهولة في الماء. يبلغ الإنتاج العالمي منها 200 مليون طن في السنة وهي أحد الكيماويات التي يكثر إنتاجها. تستخدم اليوريا في صناعة السماد الصناعي المحتوي علي الأزوت (النتروجين)، واليوريا مادة أولية للصناعات الكيماوية حيث تستخدم في تصنيع الراتنج، و اللواصق، و العوازل الكهربائية. وهي مادة تستخدم في تصنيع ميلامين وكافيين وهيدرازين والورنيش ومواد التبييض وكيماويات أخرى.
نبذة تاريخيّة
كانت اليوريا أول مركّب عضوي ينتج اصطناعياً من مواد بادئة لا عضوية، وأدى ذلك إلى هدم مبدأ الحياتية (بالإنجليزية: vitalism) أو «vis vitalis» أي القوّة الحياتيّة باللغة اللاتينيّة.
اكتُشفت المادّة كمادّة بذاتها عام 1773 من قبل «هيلار مارين رووٍيلّ» Hilaire Rouelle. وأوّل من قام بتصنيعها كان «فريدريش فوولر» Friedrich Wöhler سنة 1828 عبر عمليّة تفاعل كيميائيّة بين سيانات البوتاسيوم وسلفات الأمونيوم؛ بهذه الطريقة مهّدت الطريق لفرع الكيمياء العضوية، بعد إثباتها أنّ الموادّ العضوية يمكن أن تُنتج من أشياء وموادّ غير حيّة.
طريقة فوهلر لتحضير اليوريا
قام فريدريش فوولر بتحضير اليوريا أول مرة في عام 1838 من تفاعل سيانات الفضة (AgNCO) مع كلوريد الأمونيوم (NH4Cl):
أو كذلك من تفاعل سيانات الرصاص (Pb(NCO)2) مع الأمونيوم السائل.
ومن الناتج الوسطي سيانات الأمونيوم (NH4NCO) تعرّف على المادة الأصلية لليوريا :
بهذا كانت اليوريا هي أول مادة عضوية تحضر اصطناعيا من مواد غير عضوية. وكان هذا يتعارض آنذلك مع الفكرة السائدة بأن المواد العضوية لا تنتج سوى من كائنات حية عن طريق ما يسمى «القوة الحية».

في عام 1868 كتب «الكسندر باساروف» لأول مرة طريقة التحضير الإصطناعي لليوريا من كاربامات الأمونيوم، وذلك من الأمونيا و ثاني أكسيد الكربون تحت ضغط عال.
توصل كارل بوش في عام 1922 إلى الإنتاج الصناعي لليوريا على المستوى الكبير بتطبيق «طريقة هابر-بوش» عندما كانت الأمونيا متوفرة وكذلك توفر الضغط العالي تقنيا.
بعد الحرب العالمية الثانية ازداد تصنيع اليوريا في بلاد كثيرة حول العالم، كما زاد إنتاج الأمونيا. ووصل الإنتاج العالمي في عام 2016 ما يزيد عن 200 مليون طن.
شكل الجزيء
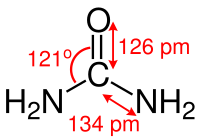
رابطة الكربون مع النتروجين تبدي خصائص الرابطة الثنائية ولذلك فتلك الرابطة نجدها أقصر في جزيء اليوريا عن رابطة الكربون - نتروجين في الألكالي أمين بنحو 10 بيكو متر. المسافة بين النتروجين والهيدروجين تبلغ 105 بيكومتر، والمسافة بين الكربون والأكسجين تبلغ 126 بيكومتر، وتبلغ المسافة بين النتروجين والكربون 134 بيكومتر.
الترابط بين الذرات N–C–N ليست مستقيمة وإنما يشكل الجزيء زاوية، وهو في مستوى واحد، أما شكل الرابطة N–H فهي في شكل هرمي. الزاوية بين الذرات N–C–O تبلغ 121 °.
تواجدها

اليوريا الطبيعية واليوريا الإصطناعية التي تتسرب إلى الطبيعة تحللها البكتيريا سريعا إلى أمونيا وأيونات نتريت ونترات وهذه هي مواد في دورة النتروجين. كلا من حمض البول واليوريا هي من المواد التي تـُخرجها الطيور والخفافيش. توجد اليوريا كمادة طبيعية في المناطق ذات المناخ الجاف. فقد عثر عليها طبيعيا في عام 1973 في «تروبن هيل»بالقرب من بحيرة راسون في غرب أستراليا, وكانت محفوفة بأمونيوم فثيتاليت وفوسفات الأمونيا.
اهميتها البيولوجية

كثير من الحيوانات الفقرية مثل صفيحية الخياشيم الغضروفية كأسماك القرش والشفنينيات والبرمائيات والثدييات تنتج اليوريا كناتج نهائي من عملية الأيض التي تتم على مركبات النتروجين مثل الأحماض الأمينية.
عند تحلل حمض أميني تنتج أمونيا أولا، وهي مادة سامة عندما يكون في تركيزها عاليا حيث تؤثر سلبا على الخلايا.
وتتكون اليوريا في الكبد خلال تفاعل جزيئين إثنين من الأمونيا مع جزيء ثاني أكسيد الكربون في دورة اليوريا. وتنتقل اليوريا من الكبد إلى الكليتين وتخرج من الجسم مع البول. نصف المواد الصلبة التي توجد في البول تقريبا يكون من اليوريا. الاختلال في دورة اليوريا تكون أسبابه وراثية وهي أحد أمراض التمثيل الغذائي، وهو مرض متعلق باختلال في تفاعلات الأمونيا. وهو يؤدي إلى ارتفاع في كمية الأمونيا في الدم، وهي ضار للخلايا العصبية.
كما تخرج كميات قليلة من اليوريا من الإنسان مع العرق وإفرازات الأمعاء. وينتج جسم الإنسان بين 20 - 39 جرام من اليوريا في اليوم.
بعض الحيوانات تستغل اليوريا في حمايتها من التصلب بسبب البرودة.
أسماك القرش و الشفنينيات لا تــُخرج كلها اليوريا ولكن تستخدمها لضبط الضغط الإسموزي الذي يساعد على انتقال المواد المختلفة بين الخلايا.
تناول طعام غني بالبروتينات بؤدي إل ارتفاع نسبي في نسبة اليوريا حتى ولو كانت الكليتان سليمتان، وهذا يُبدي نشاطا منخفضا لعمل الكلى. وإذا كانت الكلى معرضة للمرض أو إذا كانت كفاءة الكلى متواضعة بسبب مرض السكري فإن ذلك يؤدي إلى ارتفاع في مستوى وجود اليوريا في الدم (المستوى المعتاد : 10–50 مليغرام/ديسيلتر) في الدم.
توجد اليوريا في الحليب والألبان، وكمية اليوريا بالمليغرام في لتر اللبن هي مقياس هام في تغذية البقر. إن نسبة اليوريا في الحليب يحدد عن طريق تغذية البقرة بكمية مناسبة من البروتينات في اليوم و كمية الكربوهيدرات التي تخمّرها معدة البقرة، وهي تستغل كمقياس لكفاءة الحيوان في الاستفادة من البروتينات الي يأكلها. فإذا زادت نسبة البروتينات أو نقصت عن الحد المناسب في تغذية الحيوان يكون لها عواقب وخيمة على صحة الحيوان.
تصنيع اليوريا

تـُحضر اليوريا في المختبر عن طريق تفاعل الأمونيا مع الفوسجين أو مع إستر حمض الكربونيك أو كذلك التحلل المائي لسياناميد. أما التحضير الصناعي لليوريا فهو يتم بكميات كبيرة، ففي عام 2012 وصل الإنتاج العالمي منها 184 مليون طن. وطبقا لتقديرات الاتحاد الدولي لصناعة الأسمدة (IFA) فمن المتوقع زيادة الإنتاج خلال الأعوام 2013 - 2018 بنحو 41 مليون طن، من ضمنها 5 مليون طن في الولايات المتحدة وحدها. ولزيادة الإنتاج من اليوريا في الولايات المتحدة سيستلزم زيادة في استخراج الغاز من أحجار الأردواز.
لإنتاج اليوريا في مصانع كبيرة يستخدم الغاز الطبيعي والهواء والماء طبقا لطريقة هابر - بوش التي تنتج أمونيا أولا ثم أخيرا اليوريا. لإنتاج الهيدروجين أولا يُفصل ثاني أكسيد الكربون الذي يستخدم ثلثيه لإنتاج اليوريا.
طريقة إنتاج اليوريا الاصطناعي بواسطة الضغط العالي ترجع إلى «كارل بوش» و «فلهلم مايزر». شيد مصنع الكيماويات باسف مصنعه في عام 1922 حيث أنشأ فيه مفاعلا للضغط العالي كخطوة أولية بقدر 150 ضغط جوي للأمونيا وثاني أكسيد الكربون، حيث يتم هذا التفاعل وهو تفاعل منتج للحرارة فتنتج كربامات الأمونيوم (NH4CO2NH2) : />
وتتحول كربامات الأمونيوم خلال تفاعل ماص للحرارة +15,5 kJ/mol وتتحول إلى يوريا وماء:
وهو تفاعل متوازن. ولتحسين كمية الإنتاج فإن العمل يتم بكمية كبيرة غالبة أكثر من اللازم من الأمونيا. ويستحسن أن يكون الغاز الذي يُعاد إلى العملية جافا وخاليا من الماء، ذلك لأن الماء يزيح التفاعل إلى ناحية كربامات الأمونيا. التفاعل الكلي يتميز بأنه تفاعل ناشر للحرارة. ويتكون من خلاله ماتج ثانوي وهو حمض إيزوسيانيك.
هذا التفاعل يمكن تخفيضه عن طريق العمل بنسبة عالية من الأمونيا. وتستخدم شركة بي إيه إف إس في مصنعها زيادة في نسبة الأمونيا في تصنيع سلفات الأمونيا ونترات الأمونيا. في نهاية العشرينيات من القرن الماضي تم تحسين التفاعل وأعيد أرسال الأمويا الزائدة إلى عملية الإنتاج. وبنفس الطريقة طوّرت طرق شمولية تدوير للتفاعل، قامت بتطويرها شركة DuPont, وشركة Pechiney وشركة Stamicarbon".
تختلف العمليات فيما بينها من وجهة طريقة تحلل كربامات الأمونيا، وفصل وانتاج ثاني أكسيد الكربون والأمونيا وكذلك في التعامل مع اليوريا وتصنيعها.
تبلغ درجة حرارة التفاعل حسب الطريقة بين 170 - 220 درجة مئوية، وضعط التفاعل بين 125 و 250 ضغط جوي . وتشترك جميع الطرق الحديثة في شيء وهو إعادة الغازات الزائدة إلى المفاعل، حيث تتم عملية الانسلاخ stripping. يلزم لإنتاج 1 طن من اليوريا 0,58 طن من الأمونيا و 0,7 طن من ثاني أكسيد الكربون. وبحسب طريقة العملية تستخدم في أنتاجه بين 85 - 160 كيلووات ساعي من الكهرباء و بين 0,9 - 2,3 طن من البخار. خلال الإنتاج يراد خفض إنتاج مادة بيوريت التي تتكون من اليوريا عند درجات الحرارة العالية وتبقى تلك المادة في اليوريا المنتجة صناعيا كمادة دخيلة شائبة. ويرغب المنتج في خفض وجود البيوريت في اليوريا إلى أقل من 1%، حيث أن البيوريت له أثرا سلبيا على حبوب البذر مما له تأثير سيئ على الناتج الزراعي.
استخدامات اليوريا

أحد استخدامات اليوريا في الصناعة هو تصنيع الميلانين الذي يستخدم في صناعة أنواع متعددة من الراتنج، وبعض هذا الراتنج يستخدم في صناعة الأخشاب الرقائقية. وكذلك تستخدم في تحضير راتنج يوريا-فورمالدهيد. بالإضافة إلى ذلك فإن اليوريا تستخدم غالبا في تصنيع الأسمدة الأزوتية، كما تستخدم كمادة اختزال.
ويتزايد استخدامات اليوريا سنويا، قد تضاعف إنتاجها بين عامي 1960 إلى 1970 أربعة مرات. وبين عامي 1990 إلى 2010 تزايد إنتاجها والطلب عليها بمعدل 3% سنويا. ومع ذلك فإن الكفايات التقنية في تصنيعها تزيد عن الطلب بنسبة بين 10% إلى 20%. وقد يزيد من الطلب عليها يمكن أن تكون رغبة المشرعيين في خفض أكاسيد النتروجين الناتجة من سيارات المرور والحافلات وعربات النقل ـ وكذلك الرغبة في توسع إنتاج الوقود البيولوجي.
الاستخدام الطبي
تستخدم الكريمات المحتوية على اليوريا في طب الجلد كمنتجات جلدية موضعية تستخدم لعلاج جفاف الجلد. ويستخدم اليوريا بنسبة 40٪ لعلاج الصدفية و جفاف الجلد والأكزيما والتقران وغيرها.
الإنتاج العالمي لمواد اليوريا
اليوريا هي المادة شائعة الاستخدام في العالم في الأسمدة الأزوتية، وهذه الأسمدة تحتسب قيمتها على أساس ما تحتويه من نتروجين. في مناطق مختلفة من العالم، مثل أسيا، كانت نسبتها في عام 1997 ما يزيد عن 50%.
وتزايد استهلاك اليوريا شديدا في البلدان الأسيوية. في عام 2013 كانت الهند والصين وباكستان هم أكثر الدول في العالم في أستهلاك اليوريا.
| قائمة العشرة دول الولى في استخدام منتجات اليوريا | ||
|---|---|---|
| البلد | السنة | الإاستهلاك مليون طن |
| الهند | 2013 | 30,60 |
| الصين | 2012 | 28,50 |
| باكستان | 2013 | 5,89 |
| الولايات المتحدة | 2013 | 5,60 |
| إندونيسيا | 2013 | 4,77 |
| البرازيل | 2013 | 4,56 |
| كندا | 2013 | 3,38 |
| تايلاند | 2013 | 2,37 |
| مصر | 2013 | 1,93 |
| إيران | 2013 | 1,84 |

بقي سعر اليوريا حول 100 دولار أمريكي للطن، وارتفع سريعا بين 2003 - 2008 إلى 770 دولار/طن. لكنه عاد وانخفض حتى أصبح سعرها في يونيو 2016 نحو 200 دولار/طن.
| نسب أنواع الأسمدة المختلفة في العالم (على أساس النتروجين; 1997) | |
|---|---|
| السماد | نسبته المئوية |
| اليوريا | 44,22 |
| نترات الأمونيا | 9,52 |
| أمونيا | 5,67 |
| Ammoniumnitrat-Harnstoff-Lösung | 4,96 |
| Kalkammonsalpeter | 4,31 |
| Ammoniumsulfat | 3,06 |
| Andere | 28,26 |
مراجع
- ^ Williams، R. (24 أكتوبر 2001). "pKa Data" (PDF). مؤرشف من الأصل (PDF) في 2015-02-18. اطلع عليه بتاريخ 2009-11-27.
- ^ Q118929929، ص. 525، QID:Q118929929
اقرأ أيضا
| في كومنز صور وملفات عن: يوريا |