|
تضامنًا مع حق الشعب الفلسطيني |
حمى الروماتزم
| حُمّى الروماتزم | |
|---|---|
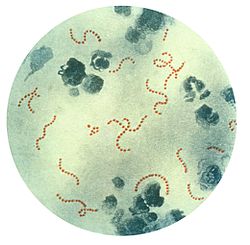 بكتيريا السبحية المقيحة (صبغ بابنهايم) هي المحفز لإحداث حمى الروماتزم.
| |
| معلومات عامة | |
| الاختصاص | طب القلب |
| أدوية | |
| تعديل مصدري - تعديل | |
حمى الروماتيزم، أو مايعرف بحمى رماتيزميه حادة، هي مرض التهابي يصيب القلب، المفاصل، الجلد، والمخ. تبدأ علامات المرض عادة بعد اسبوعين إلى اربع اسابيع من التهاب بلعومي.[1] ومن اعراضه وعلاماته الحرارة، وألم في عدة مفاصل، وحركات عضلية لا ارادية، وعلامة مميزة إلا أنها غير شائعة وهي طفح جلدي غير حاك تسمى حُمامى هامشيّة. يصاب القلب في أكثر من نصف هذه الحالات. تلف دائم لصمامات القلب أو ما يعرف بداء القلب الروماتيزمي يحدث عادة بعد عدة نوبات وقد يحدث التلف في حالات خاصة بعد نوبة حادة واحدة من الحمى الروماتيزمية، ويمكن ان تسبب هذه الصمامات المعطوبة احتشاء في عضلة القلب، وتزيد من خطورة حدوث رجفان اذيني والتهاب في الصمامات.
حمى الروماتيزم الحاده تحدث بعد التهاب بلعومي ببكتبريا تسمى بكتريا عقديه مقيِّحه. إذا لم يعالج هذا الالتهاب، فإن الحمى الروماتيزميه الحادة تحدث في 3٪ من الاشخاص.[2] يُعتَقَد ان المرض يحدث بسبب إنتاج اجسام مضادة ضد انسجة جسم المريض نفسه. بعض الناس بسبب جيناتهم معرضين أكثر للاصابه بالمرض عندما يتعرضون لهذه البكتيريا. ومن العوامل الأخرى التي تزيد من خطورة الاصابه بالمرض سوء التغذية والفقر. أما تشخيص حمى الروماتيزم فتتضمن وجود الاعراض والعلامات بالاضافه إلى دليل على عدوى بالبكتيريا العقديه مؤخرا.[3]
معالجة الناس المصابين بالتهاب بلعومي ببكتيريا عقديه بالمضادات الحيويه مثل البنسيلين تقلل من خطورة الاصابه بالحمى الروماتيزميه.[4] يحدث عادة فحص للبكتيريا العقدية في المرضى المصابين بالتهاب الحلق، ويمكن ان لا يتواجد هذا الفحص في الدول النامية، ومن الأساليب الأخرى للوقاية من هذا المرض هو تحسين الصرف الصحي. ينصح في بعض الأحيان لمرضى الحمى الرماتيزميه وداء القلب الروماتيزمي بمدة طويله من العلاج بالمضادات الحيويه. يعود المريض إلى ممارسة حياته الطبيعيه تدريجيا بعد نوبة المرض. لكن عندما يتطور المرض إلى مرحلة داء القلب الروماتيزمي يصبح العلاج أكثر صعوبة. ويمكن ان يحتاج العلاج إلى تصليح أو حتى استبدال للصمام. وتعالج المضاعفات وفقا لطبيعتها.
يصاب 325,000 طفل سنويا بالحمى الرماتيزميه، ويوجد حاليا 18 مليون شخص مصاب بداء القلب الرماتيزمي. عادة يصاب الأطفال بالحمى الرماتيزميه بين عمر 5 و 14 سنه، 20% من الحالات تحدث لديهم النوبة الأولى بعد سن البلوغ .[5] ينتشر المرض غالبا في الدول النامية وبين السكان الاصليين في الدول المتطورة.[6] حيث بلغ عدد الوفيات275,000 في سنه 2013 مقارنة ب 374,000 في سنة 1990.[7] اغلب الوفيات كانت في الدول النامية حيث سجلت نسبة الوفاة 12.5٪ سنويا من المجموع الكلي للمصابين بهذا المرض في هذه الدول. ويعود تاريخ المرض إلى القرن الخامس قبل الميلاد كما تبين في سجلات ابوقراط.[8] وتعود تسميت المرض إلى اعراضه التي تتشابه مع اعراض امراض الروماتيزم.[9]

الأعراض والعلامات
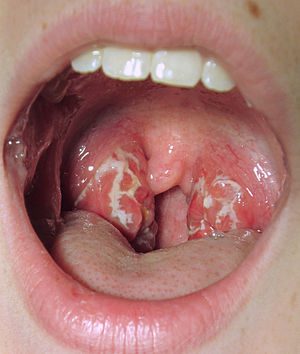
تبدأ علامات المرض عادة بعد أسبوعين إلى أربع أسابيع من التهاب بلعومي.[1] وتتضمن الأعراض:حرارة، ألم في عدة مفاصل وتتغير المفاصل المصابة مع مرور الوقت، حركات عضليه لا إرادية، وعلامة مميزة إلا أنها غير شائعة وهي طفح جلدي غير حاك تسمى حُمامى هامشيّة. يصاب القلب في أكثر من نصف هذه الحالات. وتسبب تلف دائم لصمامات القلب، يعرف بداء القلب الروماتيزمي، يحدث عادة بعد عدة نوبات، ويمكن أن يحدث في حالات خاصة بعد نوبة حمى روماتيزميه حاده واحدة. ويمكن ان تسبب هذه الصمامات المعطوبة احتشاء في عضلة القلب، وتزيد من خطورة حدوث رجفان اذيني والتهاب في الصمامات.
أخرى
- الم في البطن
- نزيف من الانف
الفزيولوجيا المرضية
الحمى الروماتيزمية مرض يصيب جميع أجهزة الجسم، حيث تصيب الأنسجة الضامة المحيطة بالشريان، وتحدث بعد عدوى غير معالجة ببكتيريا عقدية بلعومية محلله ذاتA بيتا. يُعتقد أن المرض يحدث بسبب أجسام مضادة تفاعلية متصالبة، وهذا النوع من التفاعل هو النوع الثاني من الحساسية المفرطة ويسمى التمويه الجزيئي. عادة تبقى الخلايا المناعية البائية (B cells) نشطة على السطح دون تحفيزها من قبل الخلايا التائية (T cells ). خلال عدوى العقديات، الخلايا الناضجة المظهرة للمستضد مثل خلايا B تظهر مولد الضد لخلايا CD4- T التي تتمايز إلى خلايا T2 المساعدة. خلايا T2 المساعدة تحفز خلايا B لتصبح خلايا بلازمية والتي بدورها تنتج أجسام مضادة ضد الجدار الخلوي للعقديات. ولكن الأجسام المضادة يمكن أن تتفاعل ضد بطانة القلب والمفاصل،[10] منتجة أعراض الحمى الروماتيزميه.
للبكتيريا العقدية المقيحه جدار خلوي مكون من حزم من البوليمر التي تحتوي على بروتين M والذي يعتبر مستضد للغاية. تعمل الأجسام المضادة الناتجة من جهاز المناعة ضد بروتين M تفاعل مناعي ضد بروتين الليف العضلي القلبي مايوسن،[11] و غلايكوجين عضلات القلب، وخلايا العضلات الملساء للشرايين، مما يحفز إطلاق السايتوكاينات وتدمير الأنسجة. لكن التفاعل المناعي المتصالب الوحيد المثبت هو مع الأنسجة الضامة المحيطة بالأوعية. هذا الالتهاب يحدث من خلال اتصال مباشر بين الخلايا المتممه ومستقبل Fc مما يحفز استجلاب للنيوتروفيل (العدلات) والخلايا الاكوله. أجسام آشوف المميزة، مكونه من كولاجين ايوزينوفيلي منتفخ محاط بخلايا ليمفيه وخلايا أكوله ويمكن رؤيته باستخدام المجهر الضوئي. من الممكن أن تتحول الخلايا الاكوله الأكبر إلى خلايا انتيشو أو خلايا آشوف ضخمة. الضرر الصمامي المتسبب من الروماتزم الحاد ممكن ان يتضمن أيضًا مناعة خلوية، تتضمن آفات الصمام بشكل رئيسي خلايا T المساعدة وخلايا اكوله.[12]
في الحمى الروماتيزميه، هذه الآفات يمكن أن تتواجد في أي طبقه من طبقات القلب، ولذلك سميت التهاب القلب الشامل. يمكن ان يسبب الالتهاب ارتشاح مصل فبيريني تاموري توصف بانها تأمور الخبز والزبدة والتي عادة تنتهي دون أي آثار. إشراك بطانة القلب ينتج إجمالًا نخر شبه فبريني وتكوين ثآليل على طول خط إغلاق الصمام القلب اليساري. ينتج من الترسيب ثآليل، ولكن ينتج تسميك غير متساوي من الافات التحت الشغاف تسمى لويحات ماكاليوم.
داء القلب الروماتيزمي


داء القلب الروماتيزمي المزمن يتميز بنوبات متكرره من الالتهاب والترميم الليفي. التغيرات الأساسية التي تحدث للصمامات تتضمن تسميك لشرفات الصمام، التحام في الصواري، وتسميك وتقصير في الاربطه الوتريه. تَحدُث نتيجه تفاعل مناعي ذاتي ضد بكتريا عقديه محلله نوع A بيتا تسبب تدمير للصمامات.[13] ينتج من التليف والتندب لشرفات الصمام، الصواري، والشرفات اعاقات تسبب تضيق أو قَلَس للصمامات.[14] يطلق على الالتهاب الناتج من الحمى الروماتيزميه – عادة يحدث خلال فتره الطفولة - التهاب الصمام الروماتيزمي. ويكون نصف مرضى الحمى الروماتيزميه مصابين بالتهاب بطانة الصمام. ومعظم نسبة المراضة والوفيات المتعلقة بالحمى الروماتيزمية سببها التدمير الذي تحدثه الحمى الروماتيزميه لأنسجة صمامات القلب.[14] إنّ آلية تطور المرض لداء القلب الروماتيزمي معقده وغير مفهومه بشكل كامل، لكن من المعلوم انها تتضمن التمويه الجزيئي والقابيلية الجينية التي تؤدي إلى تفاعل مناعي ذاتي.
التمويه الجزيئي يحدث عندما تتشارك الحواتم بين مولد الضد للمُضيف ومولد الضد للبكتيريا.[15] يسبب هذا تفاعل مناعي ذاتي ضد الأنسجة الأصلية في القلب التي يتم التعرف عليها بالخطأ كأجسام غريبة نتيجة التفاعلية المتصالبة للأجسام المضادة التي تتكون نتيجه الحواتم المشتركة. تكون بطانة الصمامات هي المكان الرئيسي للدمار الناتج من الخلايا الليمفية. وتعتبر خلايا CD4 T هي الخلايا الرئيسية المؤثرة في داء القلب الروماتيزمي.[16] تبدأ عمليه تحفيز خلايا T عادة بإظهار مولدات الضد للبكتيريا العقديه A. في داء القلب الروماتيزمي، يسبب التمويه الجزيئي تحفيز غير صحيح لخلايا T والتي بدورها تُحفّز خلايا B التي تبدأ بإنتاج أجسام مضادة خاصة لمولدات ضد ذاتية. وهذا ينتج استجابة مناعية ضد أنسجة القلب التي تم التعرف عليها على أساس أنها أجسام غريبة. تزيد الصمامات الروماتيزميه من استعراض VCAM-1 على سطح الخلية وهو بروتين يساعد على التصاق الخلايا الليمفيه.[17] وتتم اعاده تنظيم VCAM-1 بعد ارتباطها ببطانه الصمام عن طريق أجسام مضادة خاصة لمولدات ضد ذاتية ناتجة بسبب التمويه الجزيئي بين بروتينات الشخص ومولدات الضد للبكتيريا العقدية A، وهذا يؤدي إلى التهابات وندوبات في الصمام تُلاحظ في التهاب الصمام الروماتيزمي، والتي تحدث عاده بسبب ارتشاح لخلايا T CD4.[17] بينما تبقى القابلية الجينية غير واضحة، وجدت بعض العوامل الجينيه التي تزيد من القابلية للتفاعل المناعي المتصالب في الحمى الروماتيزميه. أما العامل الرئيسي المساهم هو النوع الثاني من الجزيء MHC ، الموجود على الخلايا الليمفيه والخلايا المقدمة لمولد الضد، خاصه أليل DR, DQ على الكروموسوم البشري 6.[18] ويزيد اتحاد أليلات معينه من التفاعل المناعي المتصالب في داء القلب الروماتيزمي. مستضد الكريات البيضاء البشري النوع الثاني (HLA class II) أليل DR7 (HLA-DR7) غالبا لها ارتباط بداء القلب الروماتيزمي، واتحادها مع أليلات معينة من DQ لها ارتباط ظاهري لنشوء الضرر الصمامي.[18] العملية التي من خلالها تزيد جزيئات MHC- II قابليه المُضيف للتفاعل المناعي التصالبي في الحمى الروماتيزميه غير معروفه، لكن من المحتمل أن لها علاقة بدور جزيء HLA في تقدمة مولد الضد لمستقبلات خلايا T، وهذا يحفز العملية المناعيه. ووجد أيضًا على كروموسوم رقم 6 سايتوكاين TNF-a الذي له علاقة بداء القلب الروماتيزمي.[18] ويفاقم الظهور عالي المستوى ل TNF-a من التهاب الأنسجة الصمامية وهذا يساهم في تطور داء القلب الروماتيزمي. مانوز بايندينغ ليكتين MBL هو بروتين التهابي يستخدم في التعرف على مسبب المرض. وتوجد مغايرات مختلفه من مواقع جين MBL2 على الحمض النووي لها علاقة بداء القلب الروماتيزمي. فالتضيق في الصمام التاجي الناتج من داء القلب الروماتيزمي له ارتباط ب MBL2 أليل التي تنسخ كميات كبيرة من MBL.[19] أما القَلَس في الصمام الأبهري في مرضى داء القلب الروماتيزمي له ارتباط ب MBL2 أليل التي تنسخ كميات قليلة من MBL.[20] وتم فحص جينات أخرى لفهم أكثر لتعقيدات التفاعليات المناعية المتصالبة في داء القلب الروماتيزمي.
التشخيص
نُشِرَ مقياس جونز المعدل لأول مرة في عام 1944 بواسطه ت. دوكيت جونز،(دكتور في الطب MD ) .[21] وكان يراجع دوريا من خلال جمعية القلب الأمريكية بالتعاون مع مجموعات أخرى.[22] واعتمادا على مقياس جونز المعدل، يتم تشخيص الحمى الروماتيزمية من خلال وجود اثنتين من المعايير الرئيسية، أو معيار رئيسي واحد ومعيارين ثانويين، مع وجود دليل على التهاب ببكتيريا عقدية: من خلال ارتفاع معيار ضد الحالّة العِقْدِيّة O أو انزيم DNAase.[5] يستثنى من ذلك رقص سيدنهام والتهاب القلب الخامل، حيث تعتبر كل واحده منهن بنفسها اشاره إلى الحمى الروماتيزميه.[23][24][25] نشرت مقاله في أبريل 2013 في الجريدة الهندية للأبحاث الطبية صرحت أن أبحاث مخطط صدى القلب ودوبلر E,D، رغم وجود تحفظات على منافعهم، ساهمت بشكل كبير في تشخيص مرض داء القلب الروماتيزمي، مما يرجح عدم كفايه مقياس جونز 1992. وشخصت أبحاث E,D التهابا للقلب مصابين بحمى الروماتيزم الحادة، وبالمثل عند متابعة مرضى حمى الروماتيزم ممن اتوا في البداية برقص سيدنهام وحدها.[26] ومن العلامات السابقة لعدوى العقديات: حمى قرمزية مؤخرًا، ارتفاع عيار مستضد الحالة العقدية O أو عيار أجسام مضادة ضد عقدية أخرى، أو موجبية زراعة الحلق.[27]
المعايير الرئيسية
- التهاب المفاصل: التهاب مؤقت متنقل في المفاصل الكبرى، عاده يبدا في الساق وينتقل إلى الاعلى.
- التهاب القلب: التهاب في عضلة القلب ( myocarditis) تظهر كفشل القلب الاحتقاني مع ضيق في التنفس، أو التهاب غلاف القلب مع احتكاك، أو نفخه قلبيه جديده.
- عقيدات تحت جلديه: تجاميع صلبة غير مؤلمة من الالياف فوق العظام أو الاربطه. عاده تظهر خلف الرسغ، خارج الكوع، وعلى مقدمة الركبة.
- حمامى هامشيه: طفح جلدي محمر طويل المدى يبدا في الجذع أو الذراع على شكل بقع، تنتشر إلى الخارج وتُمسح من الداخل لتشكل حلقه، تستمر بالانتشار لتتحد مع حلقات أخرى، لتكون شكل حيه، تنتشر إلى الوجه وتسوء مع الحرارة.
- رقص سيدنهام: سلسله من الحركات السريعه المميزه لا يتأثر بها الوجه والذراعين. تحدث في اخر اوقات المرض على الاقل ثلاث أشهر من بدايه العدوى.
المعايير الثانوية
- حراره 38.2-38.9 س ( 100,8 – 102,0 ف )
- الم مفاصل: الم في المفاصل بدون انتفاخ ( لا يتم احتسابها إذا كان التهاب المفاصل المتعدد موجود من ضمن المعايير الرئيسية)
- ارتفاع سرعه تثفل كريات الدم الحمر أو البروتين المتفاعل C
- ارتفاع الكريات البيض
- خصائص مميزه في تخطيط القلب تشير لتوقف القلب، مثل استطوال فتره PR[27][28] ( لا تحتسب إذا كان التهاب القلب من ضمن المعايير الرئيسية)
- نوبات قديمه من الحمى الروماتيزميه أو مرض قلبي خامل
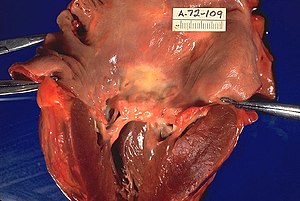
حمى الروماتيزم في جثه مشرحة مع خصائص مميزه (تسميك للصمام التاجي وتسميك الحبال الوتريه القلبيه وتضخيم بطانه البطين الايسر).
الوقاية
الوقاية من تكرار المرض يتم من خلال استئصال العدوى الحاده واعطاء مضادات حيويه وقائيه. تقترح جمعيه القلب الامريكيه المحافظة على صحة الاسنان، واعطاء مضادات حيويه وقائيه على المدى البعيد للاشخاص المعروفين بالتهاب الشغاف الجرثومي، أو زراعه قلب، أو لديهم صمام قلب صناعي، أو أنواع من عيوب قلبيه خلقيه.[29]
العلاج
ان معالجه الحمى الرروماتيزميه تتجه نحو تقليل الالتهاب بعلاجات ضد الالتهاب مثل اسبيرين أو كورتيكوستيرويد. والاشخاص الذين أثبتت الزراعة إصابتهم بعقديات الحلق يجب معالجتهم بالمضادات الحيويه. يعتبر الاسبيرين هو الدواء الأفضل ويجب ان يعطى في جرعات عاليه 100مغ/كغ/يوم. يجب متابعه الاعراض الجانبيه مثل التهاب المعدة، وتسمم بالساليسايلات. في الأطفال والمراهقين استخدام الاسبيرين والمنتجات المحتويه على الاسبيرين لها علاقة بمتلازمة ريز، وهي حاله خطرة ومميته .يجب ان يوضع بالحسبان الاخطار، والفوائد، والعلاجات البديله عند استخدام الاسبيرين والمنتجات المحتويه على الاسبيرين في الأطفال والمراهقين. يستخدم الايبوبروفين للالم وعدم الارتياح والكورتيكوستيرويد للالتهابات المتوسطه والشديده في الحمى الروماتيزميه للاطفال والمراهقين. اما استخدام الستيرويد فيبقى للحالات التي يوجد فيها دليل على اصابه القلب. استخدام الستيرويد يمكن ان يمنع الندوبات المستقبلية للانسجه ويمكن ان يمنع حدوث مضاعفات مثل التضيق التاجي. وتعطى حقنه شهريا من بينسلسن طويل المدى لمده خمس سنوات لمرضى تعرضو لنوبه واحده من الحمى الروماتيزميه. اما إذا كان هناك دليل على التهاب القلب، فان مدة العلاج قد تطول ل40 سنه ومن الاساسيات للعلاج في الحمى الروماتيزميه استمراريه استخدام مضادات حيويه بجرعات قليله ( مثل البنسلين، سلفاديازين، ايريثرومايسين) لمنع حدوث التكرار.
التطعيم
حاليا لا يوجد مطعوم للبكتيريا العقديه المقيحه، ولكن يوجد ابحاث لتطوير هذا المطعوم. تتضمن الصعوبات في ايجاد مطعوم الانواع المختلفه من البكتيريا العقديه المقيحه في الطبيعة وضروره وجود عدد كبير من الناس ووقت كثير لمحاولات صناعته بامان وكفاءه عاليه.[30]
العدوى
الاشخاص موجبيي الزراعة للعقديات المقيحه يجب علاجهم بالبنسلين مادامت الحساسية للدواء غير موجوده. هذا العلاج لن يغير مسار المرض الحاد. ان أفضل العلاجات الموجوده في كتب اوكسفورد (Oxford Handbook of Clinical Medicine) للحمى الروماتيزميه هو بينزاثين بينزيل بينيسلين.
الالتهاب
يستخدم عاده الكورتيكوستيرويد، ولكن لا يوجد دليل قوي لاثبات ذلك. ويستخدم الساليساليت لتخفيف الالم.
فشل القلب
بعض الاشخاص يصابون بالتهاب قلبي قوي تظهر اعراضه على شكل فشل قلب احتقاني. وهذا يحتاج إلى الادويه المستخدمه عاده في فشل القلب: مثبطات ACE، مدرات بول، مُحْصِر بيتا، ديجوكسين. على العكس من فشل القلب العادي، فان فشل القلب الروماتيزمي يستجيب جيدا للكورتيكوستيرويد.
الاوبئه

حمى الروماتيزم منتشره عالميا ومسؤوله عن حالات كثيره لدمار صمامات القلب.كان عدد الوفيات عالميا في 2010 بسببها 345.000 مقارنه ب 463.000 في عام1990.[32] في الدول الغربية، أصبحت نادره منذ ستينيات القرن العشرين، ربما نتيجه انتشار استخدام المضادات الحيويه لمعالجه عدوى العقديات. بينما أصبحت اقل بكثير في الولايات المتحده منذ بداية القرن العشرين ولكان هناك عدة حالات تفشي للمرض منذ 1980.على الرغم من ان المرض يحدث نادرا، الا انه مرض خطير وله نسبه وفيات من 2-5٪.[33] الحمى الروماتيزميه اساسا تصيب الأطفال بين الاعمار 5-17 سنه، وتحدث تقريبا بعد 20 يوم من التهاب الحلق. ولا تكون هناك أي اعراض بسبب عدوى البكتيريا العقيدية في ثلث الحالات. نسبه تطور الحمى الروماتيزميه في الاشخاص المصابين بعدوى عقديه غير معالجه يتوقع ان تكون3٪. ونسبه اعاده حدوثها مع عدوى متكرره غير معالجه تزداد ل(تقريبا50٪).[34] وتكون نسبه الحدوث اقل بكثير في الاشخاص المستخدمين للمضادات الحيويه للعلاج. اما الاشخاص الذين اصيبوا بحمى روماتيزميه لديهم القابلية لحدوث نوبات احتدام مع تكرار العدوى بالعقديات. تكرار الحمى الروماتيزميه نوعا ما شائع في غياب استمرار اخد جرعات صغيره من المضادات الحيوية، خصوصا في أول ثلاث إلى خمس سنين بعد أول حادثه. المضاعفات التي تصيب القلب قد تكون على المدى الطويل خطيره، خصوصا إذا كان الصمام قد اصيب. الباقين على قيد الحياه من الحمى الروماتيزميه عاده يجب ان ياخدوا بينسلين لمنع عدوى العقديات التي من المحتمل ان تؤدي إلى حالات أخرى من الحمى الروماتيزميه القاتله.
المراجع
- ^ أ ب Lee، KY؛ Rhim، JW؛ Kang، JH (مارس 2012). "Kawasaki disease: laboratory findings and an immunopathogenesis on the premise of a "protein homeostasis system"". Yonsei medical journal. ج. 53 ع. 2: 262–75. DOI:10.3349/ymj.2012.53.2.262. PMID:22318812.
- ^ Ashby، Carol Turkington, Bonnie Lee (2007). The encyclopedia of infectious diseases (ط. 3rd). New York: Facts On File. ص. 292. ISBN:9780816075072. مؤرشف من الأصل في 2020-01-24.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ "Rheumatic Fever 1997 Case Definition". cdc.gov. 3 فبراير 2015. مؤرشف من الأصل في 2015-02-19. اطلع عليه بتاريخ 2015-02-19.
- ^ Spinks، A؛ Glasziou، PP؛ Del Mar، CB (5 نوفمبر 2013). "Antibiotics for sore throat". The Cochrane database of systematic reviews. ج. 11: CD000023. DOI:10.1002/14651858.CD000023.pub4. PMID:24190439.
- ^ أ ب Kumar، Vinay؛ Abbas، Abul K؛ Fausto، Nelson؛ Mitchell، Richard N (2007). Robbins Basic Pathology (ط. 8th). Saunders Elsevier. ص. 403–6. ISBN:978-1-4160-2973-1. مؤرشف من الأصل في 2022-05-31.
- ^ Marijon، E؛ Mirabel، M؛ Celermajer، DS؛ Jouven، X (10 مارس 2012). "Rheumatic heart disease". Lancet. ج. 379 ع. 9819: 953–64. DOI:10.1016/S0140-6736(11)61171-9. PMID:22405798.
- ^ GBD 2013 Mortality and Causes of Death، Collaborators (17 ديسمبر 2014). "Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013". Lancet. ج. 385 ع. 9963: 117–171. DOI:10.1016/S0140-6736(14)61682-2. PMC:4340604. PMID:25530442.
{{استشهاد بدورية محكمة}}:|مؤلف1-الأول=باسم عام (مساعدة) - ^ Quinn، RW (1991). "Did scarlet fever and rheumatic fever exist in Hippocrates' time?". Reviews of infectious diseases. ج. 13 ع. 6: 1243–4. DOI:10.1093/clinids/13.6.1243. PMID:1775859.
- ^ "rheumatic fever" في معجم دورلاند الطبي
- ^ Abbas، Abul K.؛ Lichtman، Andrew H.؛ Baker، David L.؛ وآخرون (2004). Basic immunology: functions and disorders of the immune system (ط. 2). Philadelphia, Pennsylvania: Elsevier Saunders. ISBN:978-1-4160-2403-3.
- ^ Faé KC، da Silva DD، Oshiro SE، وآخرون (مايو 2006). "Mimicry in recognition of cardiac myosin peptides by heart-intralesional T cell clones from rheumatic heart disease". J. Immunol. ج. 176 ع. 9: 5662–70. DOI:10.4049/jimmunol.176.9.5662. PMID:16622036. مؤرشف من الأصل في 2020-03-20.
{{استشهاد بدورية محكمة}}:|archive-date=/|archive-url=timestamp mismatch (مساعدة) - ^ Cotran, Ramzi S.; Kumar, Vinay; Fausto, Nelson; Nelso Fausto; Robbins, Stanley L.; Abbas, Abul K. (2005). Robbins and Cotran pathologic basis of disease. St. Louis, Mo: Elsevier Saunders. ISBN:0-7216-0187-1. مؤرشف من الأصل في 2020-01-17.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Kaplan، MH؛ Bolande، R؛ Rakita، L؛ Blair، J (1964). "Presence of Bound Immunoglobulins and Complement in the Myocardium in Acute Rheumatic Fever. Association with Cardiac Failure". The New England Journal of Medicine. ج. 271 ع. 13: 637–45. DOI:10.1056/NEJM196409242711301. PMID:14170842.
- ^ أ ب Brice، Edmund A. W؛ Commerford، Patrick J. (2005). "Rheumatic Fever and Valvular Heart Disease". في Rosendorff، Clive (المحرر). Essential Cardiology: Principles and Practice. Totowa, New Jersey: Humana Press. ص. 545–563. DOI:10.1007/978-1-59259-918-9_30. ISBN:978-1-59259-918-9.
- ^ Guilherme، L؛ Kalil، J؛ Cunningham، M (2006). "Molecular mimicry in the autoimmune pathogenesis of rheumatic heart disease". Autoimmunity. ج. 39 ع. 1: 31–9. DOI:10.1080/08916930500484674. PMID:16455580.
- ^ Kemeny، E؛ Grieve، T؛ Marcus، R؛ Sareli، P؛ Zabriskie، JB (1989). "Identification of mononuclear cells and T cell subsets in rheumatic valvulitis". Clinical immunology and immunopathology. ج. 52 ع. 2: 225–37. DOI:10.1016/0090-1229(89)90174-8. PMID:2786783.
- ^ أ ب Roberts، S؛ Kosanke، S؛ Terrence Dunn، S؛ Jankelow، D؛ Duran، CM؛ Cunningham، MW (2001). "Pathogenic mechanisms in rheumatic carditis: Focus on valvular endothelium". The Journal of infectious diseases. ج. 183 ع. 3: 507–11. DOI:10.1086/318076. PMID:11133385.
- ^ أ ب ت Stanevicha، V؛ Eglite، J؛ Sochnevs، A؛ Gardovska، D؛ Zavadska، D؛ Shantere، R (2003). "HLA class II associations with rheumatic heart disease among clinically homogeneous patients in children in Latvia". Arthritis Research & Therapy. ج. 5 ع. 6: R340–R346. DOI:10.1186/ar1000. PMC:333411. PMID:14680508.
- ^ Schafranski، MD؛ Pereira Ferrari، L؛ Scherner، D؛ Torres، R؛ Jensenius، JC؛ De Messias-Reason، IJ (2008). "High-producing MBL2 genotypes increase the risk of acute and chronic carditis in patients with history of rheumatic fever". Molecular immunology. ج. 45 ع. 14: 3827–31. DOI:10.1016/j.molimm.2008.05.013. PMID:18602696.
- ^ Ramasawmy، R؛ Spina، GS؛ Fae، KC؛ Pereira، AC؛ Nisihara، R؛ Messias Reason، IJ؛ Grinberg، M؛ Tarasoutchi، F؛ Kalil، J؛ Guilherme، L. (2008). "Association of Mannose-Binding Lectin Gene Polymorphism but Not of Mannose-Binding Serine Protease 2 with Chronic Severe Aortic Regurgitation of Rheumatic Etiology". Clinical and Vaccine Immunology : CVI. ج. 15 ع. 6: 932–936. DOI:10.1128/CVI.00324-07. PMC:2446618. PMID:18400978.
- ^ Jones، T Duckett (1944). "The diagnosis of rheumatic fever". JAMA. ج. 126 ع. 8: 481–4. DOI:10.1001/jama.1944.02850430015005.
- ^ Ferrieri، P؛ Jones Criteria Working، Group (2002). "Proceedings of the Jones Criteria workshop". Circulation. Jones Criteria Working Group. ج. 106 ع. 19: 2521–3. DOI:10.1161/01.CIR.0000037745.65929.FA. PMID:12417554. مؤرشف من الأصل في 2011-06-08.
- ^ Parrillo، Steven J. "Rheumatic Fever". eMedicine. DO, FACOEP, FACEP. مؤرشف من الأصل في 2008-10-24. اطلع عليه بتاريخ 2007-07-14.
- ^ "Guidelines for the diagnosis of rheumatic fever. Jones Criteria, 1992 update". JAMA. Special Writing Group of the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease of the Council on Cardiovascular Disease in the Young of the American Heart Association. ج. 268 ع. 15: 2069–73. 1992. DOI:10.1001/jama.268.15.2069. PMID:1404745.
- ^ Saxena، Anita (2000). "Diagnosis of rheumatic fever: Current status of Jones criteria and role of echocardiography". Indian Journal of Pediatrics. ج. 67 ع. 4: 283–6. DOI:10.1007/BF02758174. PMID:11129913. مؤرشف من الأصل في 2022-05-31.
- ^ Kumar، RK؛ Tandon، R (2013). "Rheumatic fever & rheumatic heart disease: The last 50 years". The Indian Journal of Medical Research. ج. 137 ع. 4: 643–658. PMC:3724245. PMID:23703332.
- ^ أ ب Ed Boon, Davidson's General Practice of Medicine, 20th edition. P. 617.
- ^ Aly، Ashraf (2008). "Rheumatic Fever". Core Concepts of Pediatrics. University of Texas. مؤرشف من الأصل في 2017-07-10. اطلع عليه بتاريخ 2011-08-06.
- ^ "What About My Child and Rheumatic Fever?" (PDF). American Heart Association. مؤرشف من الأصل (PDF) في 2018-05-08. اطلع عليه بتاريخ 2014-02-23.
- ^ "Initiative for Vaccine Research (IVR) - Group A Streptococcus". World Health Organization. مؤرشف من الأصل في 2013-07-27. اطلع عليه بتاريخ 2012-06-15.
- ^ "WHO Disease and injury country estimates". World Health Organization. 2009. مؤرشف من الأصل في 2019-04-30. اطلع عليه بتاريخ 2009-11-11.
- ^ Lozano، R؛ Naghavi، M؛ Foreman، K؛ Lim، S؛ Shibuya، K؛ Aboyans، V؛ Abraham، J؛ Adair، T؛ Aggarwal، R (15 ديسمبر 2012). "Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. ج. 380 ع. 9859: 2095–128. DOI:10.1016/S0140-6736(12)61728-0. PMID:23245604.
{{استشهاد بدورية محكمة}}: الوسيط|first20=يفتقد|first20=(مساعدة)، الوسيط|الأول10=يفتقد|الأخير10=(مساعدة)، الوسيط|الأول11=يفتقد|الأخير11=(مساعدة)، الوسيط|الأول12=يفتقد|الأخير12=(مساعدة)، الوسيط|الأول13=يفتقد|الأخير13=(مساعدة)، الوسيط|الأول14=يفتقد|الأخير14=(مساعدة)، الوسيط|الأول15=يفتقد|الأخير15=(مساعدة)، الوسيط|الأول16=يفتقد|الأخير16=(مساعدة)، الوسيط|الأول17=يفتقد|الأخير17=(مساعدة)، الوسيط|الأول18=يفتقد|الأخير18=(مساعدة)، الوسيط|الأول19=يفتقد|الأخير19=(مساعدة)، الوسيط|الأول21=يفتقد|الأخير21=(مساعدة)، الوسيط|الأول22=يفتقد|الأخير22=(مساعدة)، الوسيط|الأول23=يفتقد|الأخير23=(مساعدة)، الوسيط|الأول24=يفتقد|الأخير24=(مساعدة)، الوسيط|الأول25=يفتقد|الأخير25=(مساعدة)، الوسيط|الأول26=يفتقد|الأخير26=(مساعدة)، الوسيط|الأول27=يفتقد|الأخير27=(مساعدة)، الوسيط|الأول28=يفتقد|الأخير28=(مساعدة)، الوسيط|الأول29=يفتقد|الأخير29=(مساعدة)، والوسيط|الأول30=يفتقد|الأخير30=(مساعدة) - ^ "Medline Plus Medical Encyclopedia". NLM/NIH. مؤرشف من الأصل في 2016-07-05
{{استشهاد بدورية محكمة}}: الاستشهاد بدورية محكمة يطلب|دورية محكمة=(مساعدة) والوسيط|الفصل=تم تجاهله (مساعدة)صيانة الاستشهاد: postscript (link). - ^ Porth، Carol (2007). Essentials of pathophysiology: concepts of altered health states. Hagerstown, MD: Lippincott Williams & Wilkins. ISBN:0-7817-7087-4.
وصلات خارجية
- Rheumatic fever information from Seattle Children's Hospital Heart Center
- Jones major criteria, Mnemonic
- Rheumatic Heart Disease Network
| في كومنز صور وملفات عن: حمى الروماتزم |