|
تضامنًا مع حق الشعب الفلسطيني |
ثرومبين
العامل الثاني (بالإنجليزية: factor II) أو الثرومبين[2][3] (بالإنجليزية: Thrombin) أو الخثرين، رقمه الكيميائي (EC 3.4.21.5) وهو أحد البروتينات القابلة للذوبان، وهو بروتين مشابه للألبومين، له نشاط خثري قوي، عندما يضاف إلى الدم، أو إلى محاليل مولد الليفين.[4] ويتكون خلال تخثر الدم من طليعة الخثرين، تحت تأثير الثرومبوبلاستين والكالسيوم، وربما عوامل أخرى في الدم. ولا يوجد في الدم غير المتخثر.[5]
التاريخ
بعد وصف الفبرينوجين والفيبرين، افترض الكسندر شميدت وجود إنزيم يحول الفيبرينوجين إلى الفيبرين في عام 1872.[6]
الوظيفة الحيوية
التخليق
يُنتج الثرومبين بواسطة الانقسام الإنزيمي في موقعين في البروثرومبين بواسطة االعامل العاشر Xa. يتم تعزيز نشاط العامل العاشر Xa بشكل كبير من خلال ربط العامل الخامس Va، والذي يُطلق عليه مُجمَّع البروثرومبيناز. يتم إنتاج البروثرومبين في الكبد ويتم تحويره بشكل متعدّد في تفاعل يعتمد على فيتامين ك الذي يحوّل 10-12 من أحماض الغلوتاميك في الطرف N من الجزيء إلى حمض جاما كاربوكسيغلوتاميك.[7] في وجود الكالسيوم، تعزز بقايا حمض جاما كاربوكسيغلوتاميك ارتباط البروثرومبين بالطبقات الفوسفورية. يثبط نقص فيتامين ك أو إعطاء مادة الوارفارين المضادة للتخثر إنتاج مخلفات حمض كاما كاربوكسيلوتاميك، مما يؤدي إلى إبطاء تنشيط عملية التخثر.
في البالغين، يُقاس مستوى الدم الطبيعي لنشاط مضاد الثرومبين ليكون حوالي 1.1 وحدة / مل. تزداد مستويات المولود الجديد من الثرومبين باطراد بعد الولادة لتصل إلى مستويات البالغين الطبيعية، من مستوى حوالي 0.5 وحدة / مل يوم واحد بعد الولادة، إلى مستوى حوالي 0.9 وحدة / مل بعد 6 أشهر من الحياة.[8]
آلية العمل
في مسار عملية تخثر الدم، يعمل الثرومبين على تحويل العامل العامل الحادي عشر XI إلى العامل XIa، والعامل الثامن VIII إلى العامل VIIIa، والعامل الخامس V إلى العامل Va، والفيبرينوجين إلى الفايبرين، والعامل الثالث عشرXIII إلى العامل XIIIa.
يتكون العامل الثالث عشر من ترانسغلوتاميناز يحفز تكوين روابط تساهمية بين اللايسين ومخلفات الجلوتامين في الفيبرين. تزيد الروابط التساهمية من استقرار جلطة الفيبرين. كما يتفاعل الثرومبين مع الثروموموديولين فيما يُعرف بتآثرات البروتين-بروتين.[9][10]
كجزء من نشاطه في عملية تخثرالرم، يعزز الثرومبين أيضًا من تنشيط الصفائح الدموية وتجميعها عبر تفعيل مستقبلات تنشيط البروتياز على غشاء الخلية للصفيحة.
ردود الفعل السلبية
جنبُاإلى جنب مع الثرومبوموديولين، ينشط الثرومبين بروتين سي، والذي يعتبر بمثابة مثبط لشلال التخثر. يتحسن تنشيط البروتين سي بشكل كبير بعد ربط الثرومبين إلى الثروموموديولين، وهو بروتين غشائي متكامل تم التعبير عنه بواسطة البطانة الغشائية. يثبط نشاط البروتين سي العوامل Va و VIIIa. كما يؤدي البروتين سي النشط إلى زيادة متواضعة في نشاط بروتين إس. كما يتم تثبيط الثرومبين عن طريق مضاد الثرومبين، وهو مثبط بروتياز سيرين.
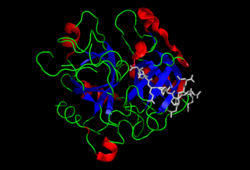
التركيب
الوزن الجزيئي للبروثرومبين هو حوالي 72000 وحدة كتل ذرية. يتم تحرير المجال الحفاز من جزء البروثرومبين 1.2 ليخلق الثرومبين النشط، والذي له وزن جزيئي قدره 36,000 وحدة كتل ذرية. يعتبر الثرومبين هيكليًا أحد أعضاء عائلة البروتياز.
يتكون البروثرومبين من أربعة مجالات؛ نطاق النهاية النيتروجينية N، واثنين من مجالات كرينغل، ومحطة تربسن - مثل مجال بروتييز السيرين. يؤدي العامل العاشرXa مع العامل الخامسV كعامل مساعد إلى انقسام في حمض جاما كاربوكسيغلوتاميك واثنين من مجالات كرينغل التي تشكل معاً جزءًا يسمى الجزء 1.2 وترك الثرومبين، الذي يتكون فقط من مجال بروتييز السيرين.[11]
كما هو الحال بالنسبة لجميع بروتييز السيرين، يتحول البروثرومبين إلى الثرومبين النشط عن طريق تحليل البروتينات في رابطة الببتيد الداخلية، مما يؤدي إلى كشف نطاق النهاية النيتروجينية N. ينطوي النموذج التاريخي لتنشيط بروتييز السيرين على إدخال هذه النهاية N الجديدة المكونة من السلسلة الثقيلة في سلسلة تنشيط النفاعل الذي يعزز الشكل الصحيح للمخلفات المحفزة.[12] على عكس التركيبات البلورية للثرومبين النشط، تشير دراسات مطيافية الكتلة لتبادل الهيدروجين والديوتريوم إلى أن نطاق النهاية النيتروجينية N لا يدخل في تفاعل الثرومبين. ومع ذلك، يبدو أن ارتباط الجزء النشط من الثرومومودولين يؤدي إلى تعزيز التشكل النشط للثرومبين عن طريق تعديل النهاية النيتروجينية N.[13]
الجينات
يقع جين الثرومبين على الكروموسوم الحادي عشر 11p11-q12.[14]
يوجد ما يُقدّر بنحو 30 شخصًا في العالم تم تشخيصهم بعيبب خلقي من نقص العامل الثاني،[15] والذي لا ينبغي الخلط بينه وبين طفرة البروثرومبين G20210A، والتي يطلق عليها أيضًا طفرة العامل الثاني. Prothrombin G20210A الخلقية.[16]
لا تقترن طفرة البروثرومبين G20210A عادةً بطفرات عوامل أخرى مثل الطفرات الأكثر شيوعًا كطفرة العامل الخامس لايدن. قد يُتوارث الجين بشكل متغاير أي من زوج واحد، أو بصورةٍ أكثر ندرةً بشكل متجانس أي من كلا الزوجان. لا يرتبط انتقال جينات الثرومبين بنوع الجنس أو فصيلة الدم. تزيد الطفرات المتماثلة من خطر الإصابة بتجلط الدم أكثر من الطفرات المتخلفة، ولكن يشظل الخطر النسبي المتزايد غير موثقًا بشكلٍ جيد. وتشمل المخاطر المحتملة الأخرى للتخثر، استخدام حبوب منع الحمل. كما توجد علاقة بين داء الأمعاء الالتهابي أي داء كرون أو التهاب القولون التقرحي وطفرة البروثرومبين G20210A أو طفرة العامل الخامسV.[17]
دور الثرومبين في المرض
يعتبر تنشيط البروثرومبين أمر بالغ الأهمية في التخثر الفسيولوجي والمرضي. وقد وُصفت العديد من الأمراض النادرة التي تعتمد على وجود خلل بالبروثرومبين مثل نقص بروثرومبين الدم. قد يكون وجود الأجسام المضادة للبروثرومبين في مرض المناعة الذاتية عاملًا في تكوين مضاد تخثر الذئبة المعروف أيضًا باسم متلازمة أضداد الفوسفوليبيد. يمكن أيضًا أن تتسبب طفرة G20210A فرط زيادة البروثرومبين في الدم.
يسبب الثرومبين تضيق الأوعية الدموية بشكل قوي، كما يعمل كعامل رئيسي في التشنج الوعائي بعد حدوث نزف تحت العنكبوتية. يتجلط الدم الناتج من تمزق أم الدم داخل القحف حول الشريان ويطلق الثرومبين. يمكن أن يؤدي هذا إلى تضيق حاد لفترة طويلة في الأوعية الدموية، مما قد يؤدي إلى نقص التروية الدماغية وحدوث الاحتشاء أو السكتة الدماغية.
إلى جانب دوره الرئيسي في العملية الديناميكية لتشكيل الجلطة، يتمتع الثرومبين بخصائص التهابية واضحة، والذي قد تؤثر على بداية وتطور تصلب الشرايين. تستطيع الهرمونات من خلال مستقبلات غشاء الخلية المحددة مثل مستقبلات تنشيط البروتيز: PAR-1 ، PAR-3 و PAR-4 والتي يتم التعبير عنها بوفرة في جميع مكونات جدار الشرايين، اتخاذ إجراءات مؤاتية لتصلب الشرايين مثل الالتهاب، وتجميع الكريات البيضاء في لويحات تصلب الشرايين، وتعزيز الإجهاد التأكسدي، وانتشار خلايا العضلات الملساء الوعائية، موت الخلايا المبرمج وتولد الأوعية الدموية.[18][19][20]
يدخل الثرومبين في فسيولوجيا الجلطات الدموية والتي تُعرف باسم الخثرة أو الجلطة. يدل وجود الثرومبين على وجود جلطة. وفي عام 2013، طُوّر نظام للكشف عن وجود الثرومبين في الفئران. يحتوي الثرومبين على ببتيد مرتبط بأكسيد الحديد يمكن أن يرتبط ببعض الكيماويات المُستخدمة في الاختبار. عندما يرتبط الببتيد بجزيء الثرومبين، تتحرر تلك الكيماويات وتظهر في البول مما يمكننا من الكشف عنه . لم يتم إجراء اختبار بشري حتى الآن.[21]
الاستخدامات
كأداة للبحث
يعتبر الثرومبين أداة بيوكيميائية قيمة، نظرًا لخصائصه العالية كعامل يسبب تحلل البروتين. عادةً ما يتم تضمين موقع انشقاق الثرومبين Leu-Val-Pro-Arg-Gly-Ser في مناطق الوصلة الخاصة ببناء البروتين الاندماجي. بعد تنقية هذا البروتين الاندماجي، يمكن استخدام الثرومبين للالتقاط الانتقائي لمخلفات الأرجنين والجلايسين في موقع الانقسام، وإزالة علامة التنقية من البروتين ذي الأهمية بدرجة عالية من الخصوصية.
الطب والجراحة
تُعتبر مُركّبات البروثرومبين المركب المُركّزة والبلازما المتجمدة الجديدة مستحضرات غنية با البروترومبين يمكن استخدامها لتصحيح حالات نقص البروثرومبين بالجسم والتي تنتج عادةً بسبب تأثيرات بعض الأدوية. تشمل المؤشرات النزف غير المتوقف بسبب الوارفارين.
كما يُعتبر التحكم بمستويات البروثرومبين عامل أساسي لأسلوب عمل معظم مضادات التخثر. يثبط الوارفارين والأدوية ذات الصلة فيتامين ك الذي يعمل كعامل محفز لإضافة مجموعة الكربوكسيل للعديد من عوامل التخثر، بما في ذلك البروثرومبين. يزيد الهيبارين من تقارب مضاد الثرومبين إلى الثرومبين وكذلك العامل العاشر Xa . ظهر في الأسواق مثبطات الثرومبين المباشرة، وهي فئة جديدة من الأدوية تمنع الثرومبين مباشرةً من الارتباط بموقعه النشط.
يتوفر الثرومبين المُركّب كمسحوق لإعادة التكوين في محلول مائي. يمكن استخدام هذا المحلول موضعيًا أثناء الجراحة كمساعد على الإرقاء. كما يمكن أن يكون مفيدًا للسيطرة على النزيف الطفيف من الشعيرات الدموية والأوردة الصغيرة، ولكنه غير فعال في وقف النزف الشرياني الهائل أو السريع.[22][23][24]
إنتاج الغذاء
يُباع الثرومبين تحت الاسم التجاري يبريماكس Fibrimex لاستخدامه كعامل مُجمّد للحوم. يُستمد الثرومبين في فيبريماكس Fibrimex من دم الخنازير أو الأبقار.[25] يمكن استخدام فيبريماكس وفقًا للشركة المصنعة لإنتاج أنواع جديدة من اللحوم المختلطة كالجمع بين لحم البقر والأسماك بسلاسة. تشير الشركة المصنعة أيضًا إلى إمكانية استخدامه للجمع بين اللحوم العضلية الكاملة من حيث الشكل والفائدة، مما يقلل بالتالي من تكاليف الإنتاج دون خسارة في الجودة.[26]
وقد صرّح الأمين العام لشركة جان بيرتفورت Jan Bertoft لجمعية المستهلكين السويديين أن «هناك خطر تضليل المستهلكين لأنه لا توجد طريقة لإخبار المستهلك أن هذا اللحم معاد تشكيله من اللحم الحقيقي».[25]
اقرأ أيضًا
مراجع
- ^ ببب: 2C93; Howard N, Abell C, Blakemore W, Chessari G, Congreve M, Howard S, Jhoti H, Murray CW, Seavers LC, van Montfort RL (فبراير 2006). "Application of fragment screening and fragment linking to the discovery of novel thrombin inhibitors". J. Med. Chem. ج. 49 ع. 4: 1346–55. DOI:10.1021/jm050850v. PMID:16480269.
{{استشهاد بدورية محكمة}}: يحتوي الاستشهاد على وسيط غير معروف وفارغ:|month=(مساعدة)صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Q118929929، ص. 514، QID:Q118929929
- ^ Q114972534، ص. 335، QID:Q114972534
- ^ Royle NJ, Irwin DM, Koschinsky ML, MacGillivray RT, Hamerton JL (مايو 1987). "Human genes encoding prothrombin and ceruloplasmin map to 11p11-q12 and 3q21-24, respectively". Somat. Cell Mol. Genet. ج. 13 ع. 3: 285–92. DOI:10.1007/BF01535211. PMID:3474786.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Degen SJ, Davie EW (سبتمبر 1987). "Nucleotide sequence of the gene for human prothrombin". Biochemistry. ج. 26 ع. 19: 6165–77. DOI:10.1021/bi00393a033. PMID:2825773.
- ^ Schmidt A (1872). "Neue Untersuchungen ueber die Fasserstoffesgerinnung". Pflüger's Archiv für die gesamte Physiologie. ج. 6: 413–538. DOI:10.1007/BF01612263.
- ^ Knorre، DG؛ Kudryashova، NV؛ Godovikova، TS (أكتوبر 2009). "Chemical and Functional Aspects of Posttranslational Modification of Proteins". Acta Nature. ج. 1 ع. 3: 29-51.
{{استشهاد بدورية محكمة}}: الوسيط|تاريخ الوصولبحاجة لـ|مسار=(مساعدة) - ^ Andrew M، Paes B، Milner R، Johnston M، Mitchell L، Tollefsen DM، Powers P (يوليو 1987). "Development of the human coagulation system in the full-term infant". Blood. ج. 70 ع. 1: 165–72. PMID:3593964.
- ^ Bajzar L، Morser J، Nesheim M (يوليو 1996). "TAFI, or plasma procarboxypeptidase B, couples the coagulation and fibrinolytic cascades through the thrombin-thrombomodulin complex". The Journal of Biological Chemistry. ج. 271 ع. 28: 16603–8. DOI:10.1074/jbc.271.28.16603. PMID:8663147.
- ^ Jakubowski HV، Owen WG (يوليو 1989). "Macromolecular specificity determinants on thrombin for fibrinogen and thrombomodulin". The Journal of Biological Chemistry. ج. 264 ع. 19: 11117–21. PMID:2544585.
- ^ Davie EW، Kulman JD (أبريل 2006). "An overview of the structure and function of thrombin". Seminars in Thrombosis and Hemostasis. 32 Suppl 1: 3–15. DOI:10.1055/s-2006-939550. PMID:16673262.
- ^ Huber، Robert؛ Bode، Wolfram (1 مارس 1978). "Structural basis of the activation and action of trypsin". Accounts of Chemical Research. ج. 11 ع. 3: 114–122. DOI:10.1021/ar50123a006. ISSN:0001-4842. مؤرشف من الأصل في 2020-03-01.
- ^ Handley LD، Treuheit NA، Venkatesh VJ، Komives EA (نوفمبر 2015). "Thrombomodulin Binding Selects the Catalytically Active Form of Thrombin". Biochemistry. ج. 54 ع. 43: 6650–8. DOI:10.1021/acs.biochem.5b00825. PMC:4697735. PMID:26468766.
- ^ Royle NJ، Irwin DM، Koschinsky ML، MacGillivray RT، Hamerton JL (مايو 1987). "Human genes encoding ثرومبين and سيرولوبلازمين map to 11p11-q12 and 3q21-24, respectively". Somatic Cell and Molecular Genetics. ج. 13 ع. 3: 285–92. DOI:10.1007/BF01535211. PMID:3474786.
- ^ Degen SJ، McDowell SA، Sparks LM، Scharrer I (فبراير 1995). "Prothrombin Frankfurt: a dysfunctional prothrombin characterized by substitution of Glu-466 by Ala". Thrombosis and Haemostasis. ج. 73 ع. 2: 203–9. PMID:7792730.
- ^ Varga EA، Moll S (يوليو 2004). "Cardiology patient pages. Prothrombin 20210 mutation (factor II mutation)". Circulation. ج. 110 ع. 3: e15-8. DOI:10.1161/01.CIR.0000135582.53444.87. PMID:15262854.
- ^ Bernstein CN، Sargent M، Vos HL، Rosendaal FR (فبراير 2007). "Mutations in clotting factors and inflammatory bowel disease". The American Journal of Gastroenterology. ج. 102 ع. 2: 338–43. DOI:10.1111/j.1572-0241.2006.00974.x. PMID:17156138.
- ^ Borissoff JI، Spronk HM، Heeneman S، ten Cate H (يونيو 2009). "Is thrombin a key player in the 'coagulation-atherogenesis' maze?". Cardiovascular Research. ج. 82 ع. 3: 392–403. DOI:10.1093/cvr/cvp066. PMID:19228706.
- ^ Borissoff JI، Heeneman S، Kilinç E، Kassák P، Van Oerle R، Winckers K، Govers-Riemslag JW، Hamulyák K، Hackeng TM، Daemen MJ، ten Cate H، Spronk HM (أغسطس 2010). "Early atherosclerosis exhibits an enhanced procoagulant state". Circulation. ج. 122 ع. 8: 821–30. DOI:10.1161/CIRCULATIONAHA.109.907121. PMID:20697022.
- ^ Borissoff JI، Spronk HM، ten Cate H (مايو 2011). "The hemostatic system as a modulator of atherosclerosis". The New England Journal of Medicine. ج. 364 ع. 18: 1746–60. DOI:10.1056/NEJMra1011670. PMID:21542745.
- ^ Economist (5 نوفمبر 2013). "Nanomedicine: Particle physiology". The Economist. مؤرشف من الأصل في 2016-05-23. اطلع عليه بتاريخ 2013-12-15.
- ^ Chapman WC، Singla N، Genyk Y، McNeil JW، Renkens KL، Reynolds TC، Murphy A، Weaver FA (أغسطس 2007). "A phase 3, randomized, double-blind comparative study of the efficacy and safety of topical recombinant human thrombin and bovine thrombin in surgical hemostasis". Journal of the American College of Surgeons. ج. 205 ع. 2: 256–65. DOI:10.1016/j.jamcollsurg.2007.03.020. PMID:17660072.
- ^ Singla NK، Ballard JL، Moneta G، Randleman CD، Renkens KL، Alexander WA (يوليو 2009). "A phase 3b, open-label, single-group immunogenicity and safety study of topical recombinant thrombin in surgical hemostasis". Journal of the American College of Surgeons. ج. 209 ع. 1: 68–74. DOI:10.1016/j.jamcollsurg.2009.03.016. PMID:19651065.
- ^ Greenhalgh DG، Gamelli RL، Collins J، Sood R، Mozingo DW، Gray TE، Alexander WA (2009). "Recombinant thrombin: safety and immunogenicity in burn wound excision and grafting". Journal of Burn Care & Research. ج. 30 ع. 3: 371–9. DOI:10.1097/BCR.0b013e3181a28979. PMID:19349898.
- ^ أ ب "Sverige röstade ja till köttklister" [Sweden voted in favor of the meat paste] (بالسويدية). Dagens Nyheter. 9 Feb 2010. Archived from the original on 2010-08-25. Retrieved 2010-10-17.
- ^ "Welcome to Fibrimex". Fibrimex website. FX Technology. مؤرشف من الأصل في 2019-01-05. اطلع عليه بتاريخ 2010-10-17.
لمزيد من القراءة
- Esmon CT (يوليو 1995). "Thrombomodulin as a model of molecular mechanisms that modulate protease specificity and function at the vessel surface". FASEB Journal. ج. 9 ع. 10: 946–55. PMID:7615164.
- Wu H، Zhang Z، Li Y، Zhao R، Li H، Song Y، Qi J، Wang J (أكتوبر 2010). "Time course of upregulation of inflammatory mediators in the hemorrhagic brain in rats: correlation with brain edema". Neurochemistry International. ج. 57 ع. 3: 248–53. DOI:10.1016/j.neuint.2010.06.002. PMC:2910823. PMID:20541575.
- Lenting PJ، van Mourik JA، Mertens K (ديسمبر 1998). "The life cycle of coagulation factor VIII in view of its structure and function". Blood. ج. 92 ع. 11: 3983–96. PMID:9834200.
- Plow EF، Cierniewski CS، Xiao Z، Haas TA، Byzova TV (يوليو 2001). "AlphaIIbbeta3 and its antagonism at the new millennium". Thrombosis and Haemostasis. ج. 86 ع. 1: 34–40. PMID:11487023.
- Maragoudakis ME، Tsopanoglou NE، Andriopoulou P (أبريل 2002). "Mechanism of thrombin-induced angiogenesis". Biochemical Society Transactions. ج. 30 ع. 2: 173–7. DOI:10.1042/BST0300173. PMID:12023846.
- Howell DC، Laurent GJ، Chambers RC (أبريل 2002). "Role of thrombin and its major cellular receptor, protease-activated receptor-1, in pulmonary fibrosis". Biochemical Society Transactions. ج. 30 ع. 2: 211–6. DOI:10.1042/BST0300211. PMID:12023853.
- Firth SM، Baxter RC (ديسمبر 2002). "Cellular actions of the insulin-like growth factor binding proteins". Endocrine Reviews. ج. 23 ع. 6: 824–54. DOI:10.1210/er.2001-0033. PMID:12466191.
- Minami T، Sugiyama A، Wu SQ، Abid R، Kodama T، Aird WC (يناير 2004). "Thrombin and phenotypic modulation of the endothelium". Arteriosclerosis, Thrombosis, and Vascular Biology. ج. 24 ع. 1: 41–53. DOI:10.1161/01.ATV.0000099880.09014.7D. PMID:14551154.
- De Cristofaro R، De Candia E (يونيو 2003). "Thrombin domains: structure, function and interaction with platelet receptors". Journal of Thrombosis and Thrombolysis. ج. 15 ع. 3: 151–63. DOI:10.1023/B:THRO.0000011370.80989.7b. PMID:14739624.
- Tsopanoglou NE، Maragoudakis ME (فبراير 2004). "Role of thrombin in angiogenesis and tumor progression". Seminars in Thrombosis and Hemostasis. ج. 30 ع. 1: 63–9. DOI:10.1055/s-2004-822971. PMID:15034798.
- Bode W (2007). "Structure and interaction modes of thrombin". Blood Cells, Molecules & Diseases. ج. 36 ع. 2: 122–30. DOI:10.1016/j.bcmd.2005.12.027. PMID:16480903.
- Wolberg AS (مايو 2007). "Thrombin generation and fibrin clot structure". Blood Reviews. ج. 21 ع. 3: 131–42. DOI:10.1016/j.blre.2006.11.001. PMID:17208341.
- Degen S: Prothrombin. In: High K, Roberts H, eds. Molecular Basis of Thrombosis and Hemostasis. New York, NY: Marcel Dekker; 1995:75.
وصلات خارجية
- The ميروبس online database for peptidases and their inhibitors: S01.217
- GeneReviews/NCBI/NIH/UW entry on Prothrombin Thrombophilia
- Anti-coagulation & proteases على يوتيوب by The Proteolysis Map-animation
- [3] PMAP: The Proteolysis Map/Thrombin
- Thrombin: RCSB PDB Molecule of the Month
- Prothrombin Structure
| في كومنز صور وملفات عن: ثرومبين |