|
تضامنًا مع حق الشعب الفلسطيني |
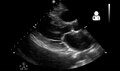
انصباب جنبي
| انصباب جنبي | |
|---|---|
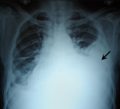
Massive left-sided pleural effusion (whiteness) in a patient presenting with lung cancer.
| |
| تعديل مصدري - تعديل |

الانصباب الجنبي أو الارتشاح البِلّوري (الانسكاب البِلّوري) هو زيادة في تراكم السائل الموجود بالتجويف البِلّوري المحيط بالرئتين. تلك الكميات الزائدة من السائل يمكن لها أن تعوق التنفس عن طريق الحد من تًوًسُع الرئتين أثناء الشهيق.

أنواع
يمكن استخدام طرق مختلفة لتصنيف السائل الجنبي.[1] حسب أصل السائل:
- السائل المصلي (موه الصدر)
- الدم - (تدمي الصدر)
- الكيلوس وهو سائل يتكون من السائل الليمفاوي وبعض الدهون (تسرب الكيلوس).
- صديد (دبيلة جنبية أو دبيلة)
- بول (بول الصدر)
عن طريق الفيزيولوجيا المرضية:
- الانصباب الجنبي الإرتشاحي
- الانصباب الجنبي النضحي
التشخيص

عادة ما يتم تشخيص الارتشاح البِلّوري على أساس السيرة المرضية والفحص السريري، ويتم تأكيد التشخيص بواسطة تصوير الصدر بالأشعة السينية. بمجرد أن يبلغ حجم السوائل المتراكمة أكثر من 500 مل، عادة ما تكون هناك أعراض سريرية عند الكشف على المريض، مثل انخفاض حركة الصدر على الجانب المتضرر، انكتام الصوت عند القرع على الجانب المتضرر، انخفاض أصوات التنفس على الجانب المتضرر، وانخفاض الرنين الصوتي والحسيس (رغم أن تلك علامة غير مُتًّسِقة وغير موثوق بها)، والاحتكاك الجنبي. في الجزء الموجود فوق الارتشاح حيث تكون الرئة مضغوطة، قد يكون هناك تنفس من الشعب الهوائية وصوت ثغاء. في حالة وجود ارتشاح كبير، قد تنحرف القصبة الهوائية بعيداً عن الارتشاح. أظهر استعراض منهجي (2009) تم نشره كجزء من سلسلة «الفحص السريري الرشيد Rational Clinical Examination» في مجلة الجمعية الطبية الأميركية أن انكتام الصوت عند القرع التقليدي هو الأكثر دقة لتشخيص الارتشاح البِلّوري (ملخص نسبة الاحتمال الإيجابية، 8.7 ؛ مدى الثقة 95 ٪، 2.2 -33.8)، في حين أن انخفاض الحفيف الملموس tactile vocal fremitus يجعل وجود الارتشاح البِلّوري أقل احتمالاً (نسبة الاحتمالات السلبية، 0.21، مدى الثقة 95 ٪، 0,12-0,37).[2]
الأشعات
عادةً (في الوضع الطبيعي) لا يمكن رؤية الفراغ الموجود بين طبقتي الغشاء البِلُّوري: الغشاء البِلّوري الجداري (أي المُبَطّن للقفص الصدري) والغشاء البِلّوري الحشوي (أي الذي يغطي الرئة). والارتشاح البِلّوري يتسرب ليملأ الفراغ الموجود بين هاتين الطبقتين. وبما أن الارتشاح البِلّوري له كثافة مماثلة لسوائل الجسم (أو الماء)، فإنه من الممكن رؤيته من خلال صور الأشعات. وبما أن للارتشاح كثافة أعلى من كثافة بقية الرئة (حيث أن الرئة تحتوي على الهواء) فإنه ينجذب إلى الجزء السفلي من التجويف البِلّوري. يتصرف الارتشاح البِلّوري وفقا لديناميات السوائل الأساسية، متسقاً مع شكل الرئة وتجويف الصدر. وإذا كان التجويف البِلّوري يحتوي على كل من الهواء والسائل (hydropneumothorax)، فإن السائل سيكون له مستوى أفقي "fluid level" بدلاً من أن يتسق مع مساحة الرئة.[3] لأشعات الصدر المُلتَقَطة في الوضع الجانبي lateral decubitus position (أي مع وضع المريض على جانبه أثناء التقاط الأشعة) حساسية أكبر، ويمكنها الكشف عن وجود الارتشاح في حال وجود حتى اقل من 50 مل من السوائل. يلزم وجود 300 مل على الأقل من السوائل حتى يتسنى لأشعات الصدر في الوضع القائم (upright position) الكشف عن بعض علامات الارتشاح البِلّوري (على سبيل المثال، التحام الزاوية بين الضلوع والحجاب الحاجز costophrenic angle).

بزل الصّدر
حالما يتم تشخيص الارتشاح البِلّوري، لا بد من تحديد السبب. يتم سحب السائل المتراكم من الفراغ البِلّوري في عملية تسمى بزل Thoracocentesis. يتم إدخال إبرة إلى داخل الفراغ البِلّوري من خلال الصدر عبر الفراغ السادس، أو السابع، أو الثامن بين الضلوع وبعضها بالتقاطع مع خط منتصف الإبط midaxillary line. قد يتم تقييم السائل بعد ذلك من حيث:
- التركيب الكيميائي بما في ذلك نسبة البروتين، انزيم نازعة هيدروجين اللاكتات، نسبة الألبومين، انزيم الأميلاز، ودرجة الحموضة والجلوكوز.
- عمل مزرعة وصبغة غرام لتحديد العدوى البكتيرية المحتملة.
- إحصاء الخلايا وتعدادها.
- [علم أمراض الخلايا Cytopathology] أي فحص الخلايا مجهرياً للكشف عن الخلايا السرطانية، أو تحديد بعض الكائنات المعدية.
- من الممكن إجراء فحوصات أخرى تبعاً لحالة المريض - كنسبة الدهنيات، ومزرعة الفطريات والمزرعة الفيروسية، وبعض الغلوبيلونيات المناعية المحددة.
معايير لايت
| الرَشْحَة | النَضْحَة | |
|---|---|---|
| الأسباب الرَئيسية | ↑ الضغط الهيدروستاتيكي وَ↓ الضغط التناضحي الغرواني | الالتهابات (زيادة النفاذية الوعائية) |
| المظهر | صافي[4] | غائم[4] |
| الكثافة النوعية | < 1.012 | > 1.020 |
| المحتوى البروتيني | < 2.5 غ/ديسيليتر | > 2.9 غ/ديسيليتر[5] |
| بروتينات المصل | < 0.5 | > 0.5[6] |
| فرق الالبومين بالمقارنة مع البومين الدم | > 1.2 غ/ديسليتر | < 1.2 غ/ديسيليتر[7] |
| إنزيم نازع هيدروجين اللاكتات (الحد الأعلى في المَصل) | < 0.6 أو < 2/3 | > 0.6[5] أَو > 2/3[6] |
| المحتوى الكوليسترولي | < 45 ملغرام/ديسيليتر | > 45 ملغرام/ديسيليتر[5] |
تُعَد تعريفات المصطلحات «الإراقة» و«الإفراز» مصدرا لكثير من الالتباس.
يتم تعريف الارتشاح البِلّوري الرائق بأنه الناتج عن عوامل كُلّية (أو جهازية) systemic تؤدي إلى تغير التوازن البِلّوري، أو قوى ستارلينغ Starling forces. تتأثر قوى ستارلينغ (الضعط الهيدروستاتيكي hydrostatic pressure، والنفاذية permiability، والضغط الجرمي oncotic pressure (الضغط الفعال بسبب الفرق بين تكوين الدم والسوائل البِلّورية)، في العديد من الأمراض مثل فشل البطين الأيسر (فشل القلب)، الفشل الكلوي، والفشل الكبدي، وتشمّع الكبد. وعلى النقيض من ذلك، فإن الارتشاح البللوري الإفرازي (أو الاحتقاني) Exudative ينتج عن تغيرات في العوامل المحلية التي تؤثر على تكوين وامتصاص السوائل البِلّورية (مثل الالتهاب الرئوي البكتيري والسرطان والانصمام الرئوي، والعدوى الفيروسية).[8]
يعتمد التشخيص الدقيق لسبب الارتشاح، وتحديد النوع إراقة أم افراز، على مقارنة العوامل الكيميائية في السائل البِلّوري بتلك الموجودة في الدم وذلك باستخدام معايير لايت. وفقا لمعايير لايت (لايت، وآخرون 1972)، فإن الارتشاح البِلّوري من المرجح أن يكون من النوع الإفرازي (أو الاحتقاني Exudative) إذا توافر على الأقل واحد من العوامل التالية:[9]
- النسبة بين البروتين في السائل البِلّوري إلى البروتين في الدم أكبر من 0.5
- النسبة بين انزيم نازعة هيدروجين اللاكتات في السائل البِلّوري والدم أكبر من 0.6
- انزيم نازع الهيدروجين عن حمض اللاكتوز (Lactate dehydrogenase - LDH)2⁄3 ، [9] في السائل البِلّوري أكبر من 0.6 [5] أو 2⁄3 [9] ثلثي الحد الطبيعي الأعلى لنسبته في الدم. المختبرات المختلفة لها قيم مختلفة للحد الطبيعي الأعلى لانزيم الـLDH في الدم، ولكن الأمثلة تشمل 200 [10] و 300 [10] وحدة دولية / لتر.[11]
على الرغم من أن معايير لايت دقيقة نسبيا، فإن 25 في المئة من المرضى الذين يعانون من الارتشاح البِلّوري المُراق (transudative) يتم تشخيصهم عن طريق الخطأ وفقا لمعايير لايت بأنهم يعانون من النوع الإفرازي (أو الاحتقاني Exudative). ولذلك، إذا كان المريض يعاني من وجود ارتشاح بِلّوري افرازي (احتقاني) تبعاً لمعايير لايت، بينما يُعاني إكلينيكياً من أحد الحالات المؤدية للارتشاح المُراق فإن ذلك يستدعي إجراء المزيد من الفحوصات. في مثل هذه الحالات يتم قياس مستويات الزلال في الدم والسوائل البِلّورية. إذا كان الفرق بين مستويات الزلال في الدم والسائل البِلّوري أكبر من 1.2 جم / ديسيلتر (12 غرام / لتر)، فإن ذلك يُرجح احتمالية وجود ارتشاح بِلّوري من النوع الإراقي transudative.[7] ومع ذلك، فإن اختبارات السائل البِلّوري غير كاملة، واتخاذ قرار نهائي حول ما إذا كان السائل هو من النوع الإراقي أم الافرازي لا يعتمد كُلياً على التحليل الكيميائي للسوائل، ولكن على التشخيص الدقيق للمرض الذي نتج عنه السائل.
تم استخدام التعريفات التقليدية لأسباب الارتشاح البِلّوري الإراقي على أنه الناجم عن عوامل جهازية (Systemic) والارتشاح البِلّوري الافرازي باعتباره ناتجاً عن عوامل محلية منذ عام 1940 أو قبل ذلك (لايت وآخرون، 1972). قبل دراسة لايت التاريخية والتي اعتمدت على أعمال شاندراسيخار Chandrasekhar، حاول الباحثون دون جدوى استخدام معايير أخرى، مثل الثقل النوعي، ودرجة الحموضة ومحتوى البروتين في السائل، للتمييز بين النوع الإراقي والإفرازي. تتميز معايير لايت إحصائياً بحساسية كبيرة Sensitivity في الكشف عن النوع الإفرازي للارتشاح البِلّوري (وإن لم تكن تتميز إحصائياً بالنوعية أو الخصوصية الكبيرة (Specificity)). أُجريت دراسات أحدث لدراسة خصائص السوائل البِلّورية التي قد تساعد في تحديد ما إذا كانت ناتجة عن أسباب محلية local (الإفرازات) أو النظامية systemic (الإراقة). يوضح الرسم البياني المرفق بعض نتائج هذه الدراسات الحديثة. مع ذلك، ينبغي ألا يغيب عن الذهن أن معايير لايت لا تزال هي المعايير الأكثر استعمالا.
وقد أظهرت دراسة الفحص السريري الرشيد (Rational Clinical Examination) المذكورة سابقاً أن حالات الارتشاح الثنائية (bilateral) - أي على جانبي الصدر - سواءً المتماثلة أو غير المتماثلة، هي الأكثر شيوعاً في حالة فشل القلب (60% من حالات الارتشاح البِلّوري في حالة فشل القلب تكون ثنائية) عندما يكون هناك عدم تناسق (أو عدم تماثل) في الارتشاح البِلّوري المرتبط بفشل القلب (إما حدوث الارتشاح على جانب واحد أو حدوثه على جانب واحد أكبر من الجانب الآخر)، فإن الجانب الأيمن عادةً ما يكون هو الأكثر تأثراً عن الجانب الأيسر.[2]
الأسباب
النوع الإراقي Transudative
من أكثر الأسباب شيوعاً للارتشاح البِلّوري الإراقي في الولايات المتحدة هي فشل القلب (أو فشل البطين الأيسر تحديداً)، والتليف الكبدي (مما يسبب ارتشاح كبدي مائي بالصدر). كان من المُعتَقَد سابقاً أن الانسدادات الرئوية (أو الجلطات الرئوية Pulmonary embolisms) تسبب النوع الإراقي من الارتشاح، غير أنه قد ظهر مؤخراً أنها تسبب النوع الإفرازي[12]
النوع الإفرازي Exudative
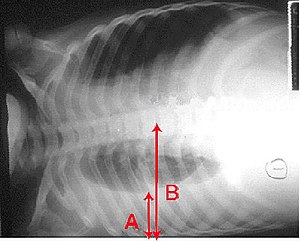
بمجرد أن يتم تشخيص الارتشاح على أنه من النوع الإفرازي، فإن المزيد من الفحص يجب إجراءه لتحديد سبب السائل، فيتم قياس نسبة إنزيم الأميليز amylase والجلوكوز ونسبة الحموضة وعدّ الخلايا في السائل البِلّوري.
- ترتفع نسبة إنزيم الأميليز في السائل البِلّوري في حالات تمزق المريء، أو الارتشاح البِلّوري البنكرياسي، أو السرطان.
- تنخفض نسبة الجلوكوز في السائل البِلّوري مع مرض السرطان، والعدوى البكتيرية، أو الالتهاب البِلّوري الروماتويدي Rheumatoid Pleuritis.
- تنخفض درجة الحموضة في السائل البِلّوري في لأقل من 7.2 في حالات الصديد البِلّوري Empyema، كما يمكن أن تنخفض في حالات السرطان.
- إذا كان يشتبه في مرض السرطان، فإن السائل البِلّوري يتم إرساله للكشف على الخلايا Cytology. إذا كانت نتيجة الكشف الخلوي سلبية، وما زال هناك اشتباه في السرطان، فإنه من الممكن إجراء إما تنظير الصدر أو إبرة الخزعة needle biopsy[13] من الغشاء البِلّوري.
- يتم إرسال السائل كذلك لعمل صبغة غرام Gram stain ومرزعة، وإذا كان هناك اشتباه في وجود مرض السل، يتم الكشف عن علامات السل (الأدينوساين دي أميناز adenosine deaminase أكبر من 45 وحدة دولية / لتر، الإنترفيرون جاما أكبر من 140 بيكوغرام / مل، أو يتم عمل فحص تفاعل البلمرة المتسلسل PCR للكشف عن الحمض النووي للسل).
أكثر الأسباب شيوعاً للارتشاح البِلّوريالاحتقاني (الإفرازي) هي الالتهاب الرئوي البكتيري، والسرطان (مع سرطان الرئة، وسرطان الثدي والأورام الليمفاوية والتي تسبب حوالي 75 ٪ من جميع حالات الارتشاح البِلّوري الخبيثة)، والعدوى الفيروسية، والانسداد الرئوي.
أسباب أخرى / غير مُصَنّفة
الأسباب الأخرى للارتشاح البِلّوري تشمل مرض السل (على الرغم من أن عينات السائل البِلّوري نادراً ما تكون إيجابية للجراثيم المُسَببة لمرض السُل Acid Fast Bacilli - AFB، وهذا هو السبب الأكثر شيوعا للارتشاح البِلّوري في بعض البلدان النامية)، وأمراض المناعة الذاتية مثل الذئبة الحمراء، والنزيف (غالبا ما بسبب صدمة للصدر)، وتراكم الكيلوس بالصدر chylothorax (غالباً بسبب صدمة للصدر)، والحقن المفاجيء أو غير المتوقع للسوائل.
الأسباب الأقل شيوعاً تشمل تمزق المريء مرض البنكرياس، الخراج داخل البطن، والتهاب المفاصل الروماتويدي، الارتشاح البِلّوري الناتج عن الاسبستوس، متلازمة ميغز Meig's syndrome (استسقاء بالبطن وارتشاح بِلّوري بسبب ورم حميد بالمبيض)، ومتلازمة فرط تحفيز المبيض.
يمكن أن يحدث الارتشاح البِلّوري كذلك بسبب العمليات الجراحية و/أو التدخلات الطبية، بما في ذلك استخدام الأدوية (يكون السائل البِلّوري عادة eosinophilic) أي يتقبل الصبغة الحمراء، عمليات الشريان التاجي، العمليات الجراحية في البطن، علاج الدوالي بالمنظار endoscopic variceal sclerotherapy، العلاج الإشعاعي، زراعة الكبد أو الرئة، ووضع الخطوط المركزية داخل أو خارج الأوردة والشرايين.
العلاج
يعتمد العلاج على السبب الكامن وراء الارتشاح البِلّوري.
قد يكون البزل العلاجي theraputic aspiration كافيا في بعض الحالات؛ بينما قد تتطلب حالات الارتشاح الأكبر استخدام أنبوبة صدرية Intercostal drain. عند استخدام هذه الأنابيب الصدرية من المهم جداً التأكد من عدم انسدادها أو انثناءها على نفسها. انسداد الأنبوبة الصدرية مع وجود إنتاج مستمر للسائل البِلّوري قد يسبب وجود ارتشاح متبقي بالصدر بعد إزالة الأنبوبة الصدرية. يمكن أن يسبب هذا السائل بعض المضاعفات مثل نقص الأكسجين hypoxia بسبب انهيار الرئة من السوائل lung collapse، أو تليف بالصدر fibrothorax بعد وقت متأخر، عندما يبدأ التجويف البِلّوري في تكوين ندبة. في حالات الارتشاح المتكررة قد يتطلب الأمر إجراء لصق بِلّوري Pleurodesis إما كيميائياً باستخدام (التلك، البليومايسين، التتراسيكلين / الدوكسيسيكلين) أو جراحياً، حيث يتم لصق طبقتي الغشاء البِلّوري مع بعضهما البعض بحيث لا يمكن أن تتراكم السوائل بينهما. يتم ذلك عن طريق إجراء جراحي ينطوي على إدخال أنبوب في الصدر، ثم إما كشط الغشاء البِلّوري ميكانيكياً، أو إدخال مواد كيميائية لإحداث ندبة لاصقة. ويتطلب هذا إبقاء أنبوب الصدر حتى يتوقف صرف السائل البِلّوري. قد يستغرق هذا إما أياماً أو أسابيع، ويمكن أن يتطلب البقاء بالمستشفى لفترات طويلة. وإذا حدث انسداد في أنبوب الصدر فإن بعضاَ من السائل قد يبقى متراكماً مما يؤدي لفشل عملية اللصق البِلّوري.
تفشل عملية اللصق البِلّوري Pleurodesis في ما يصل إلى 30 ٪ من الحالات. والبديل هو وضع قسطرة صرف من نوع Pleurex أو Aspira. وهي عبارة عن أنبوب صدر ذو سُمك 15Fr مع صمام أحادي الاتجاه. يقوم المريض أو مقدم الرعاية الصحية كل يوم بربط الأنبوب يماكينة شفط بسيطة حيث يتم إزالة من 600 سم إلى 1000 سم مكعب. ويمكن تكرار ذلك يوميا. ويتم غلق الأنبوب عندما لا يكون قيد الاستعمال. هذا يسمح للمريض أن يكون خارج المستشفى. بالنسبة لمرضى الارتشاح البِلّوري الخبيث، فإنها تتيح لهم مواصلة علاجهم الكيميائي، إذا احتاجوا لذلك. عموماً يبقى ذلك الأنبوب حوالي 30 يوماً ومن ثم تتم إزالته عند حدوث عملية لصق للغشاء البِلّوري بشكل تلقائي.
معرض صور
انظر أيضًا
- الصديد الصدري Empyema
- فشل القلب Heart Failure
- الانسداد الرئوي Pulmonary Embolism
- الارتشاح ما تحت البِلّوري Subpulmonic effusion
- البزل الصدري Thoracocentesis
- تسرب الكيلوس
وصلات خارجية
- مقالة طبية على موقع ميدلاين عن الارتشاح البِلّوري Medline Plus Article on Pleural Effusion
- الارتشاح البِلّوري مركز السرطان الافتراضي Pleural Effusion Virtual Cancer Centre
- صور للارتشاح البِلّوري من MedPix.
- انصباب الجنب - موقع الطبيب - العربية
المراجع
- ^ Grundy، Seamus (2018-08). "Pleural effusion". Oxford Medicine Online. DOI:10.1093/med/9780199568741.003.0019. مؤرشف من الأصل في 2023-01-04.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - ^ أ ب [1] ^ Wong CL, Holroyd-Leduc J, Straus SE Does this patient have a pleural effusion? JAMA. 2009 Jan 21;301(3):309-17 ببمد: 19155458
- ^ Squire, Lucy Frank; Novelline, Robert A. (2004). Squire's fundamentals of radiology. Cambridge: Harvard University Press. ص. 132–133. ISBN:0-674-01279-8.
{{استشهاد بكتاب}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب The University of Utah • Spencer S. Eccles Health Sciences Library > WebPath images > "Inflammation".
- ^ أ ب ت ث Heffner J, Brown L, Barbieri C (1997). "Diagnostic value of tests that discriminate between exudative and transudative pleural effusions. Primary Study Investigators". Chest. ج. 111 ع. 4: 970–80. DOI:10.1378/chest.111.4.970. PMID:9106577.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) وسم<ref>غير صالح؛ الاسم "Heffner" معرف أكثر من مرة بمحتويات مختلفة. - ^ أ ب Light R, Macgregor M, Luchsinger P, Ball W (1972). "Pleural effusions: the diagnostic separation of transudates and exudates". Ann Intern Med. ج. 77 ع. 4: 507–13. DOI:10.7326/0003-4819-77-4-507. PMID:4642731.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب Roth BJ, O'Meara TF, Gragun WH (1990). "The serum-effusion albumin gradient in the evaluation of pleural effusions". Chest. ج. 98 ع. 3: 546–9. DOI:10.1378/chest.98.3.546. PMID:2152757.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) وسم<ref>غير صالح؛ الاسم "pmid2152757" معرف أكثر من مرة بمحتويات مختلفة. - ^ [5] ^ Light Richard W, "Chapter 257. Disorders of the Pleura and Mediastinum" (Chapter). Fauci AS, Braunwald E, Kasper DL, Hauser SL, Longo DL, Jameson JL, Loscalzo J: Harrison's Principles of Internal Medicine, 17th Edition
- ^ أ ب ت Light R, Macgregor M, Luchsinger P, Ball W (1972). "Pleural effusions: the diagnostic separation of transudates and exudates". Ann Intern Med. ج. 77 ع. 4: 507–13. PMID:4642731.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ أ ب Joseph J, Badrinath P, Basran GS, Sahn SA (نوفمبر 2001). "Is the pleural fluid transudate or exudate? A revisit of the diagnostic criteria" (PDF). Thorax. ج. 56 ع. 11: 867–70. PMC:1745948. PMID:11641512. مؤرشف من الأصل (PDF) في 2020-01-11.
{{استشهاد بدورية محكمة}}: صيانة الاستشهاد: أسماء متعددة: قائمة المؤلفين (link) - ^ Joseph، J.؛ Badrinath، P.؛ Basran، G. S.؛ Sahn، S. A. (2002). "Is albumin gradient or fluid to serum albumin ratio better than the pleural fluid lactate dehydroginase in the diagnostic of separation of pleural effusion?". BMC Pulmonary Medicine. ج. 2: 1. DOI:10.1186/1471-2466-2-1. PMC:101409. PMID:11914151. [1] نسخة محفوظة 6 يوليو 2015 على موقع واي باك مشين.
- ^ [21] ^ Porcel et al Current Opinion in Pulmonary Medicine 2008, 14:337–342 ببمد: 18520269
- ^ [23] ^ A modified outer cannula can help thoracentesis after pleural biopsy. de Menezes Lyra R. Chest. 1997 Jul;112(1):296.[22]
| في كومنز صور وملفات عن: انصباب جنبي |