|
تضامنًا مع حق الشعب الفلسطيني |
هيدروكسيلاز-21
هذه مقالة غير مراجعة. (يناير 2021) |
الستيرويد 21- هيدروكسيلاز ، ويسمى أيضًا ستيرويد 21- أحادي أوكسيجيناز ، [1] 21α-هيدروكسيلاز ، [2] وبشكل أقل عادة ، 21β-هيدروكسيلاز ، [3][4] هو إنزيم الهيدروكسيلات المنشطات في موضع C21 [5][6] ويشارك في التخليق الحيوي للألدوستيرون والكورتيزول .و يعمل الإنزيم على تحويل البروجسترون و 17α-هيدروكسي بروجستيرونين إلى 11-ديوكسيكورتيكوستيرون و 11-ديوكسيكورتيسول ، على التوالي.[7][8] ثم يستمرّ المنتوجات من التحويلات بعد ذلك خلال مساراتها المناسبة نحو إنتاج الألدوستيرون والكورتيزول. يتم وضع الإنزيم في الأغشية الشبكية الإندوبلازمية لقشرة الغدة الكظرية ، [9][10] ويتم ترميزه من قبل جين CYP21A2 في البشر.
وظيفة

يلستيرويد 21-هيدروكسيلاس (أو ببساطة 21-هيدروكسيلاس) يسمى الانزيم بهذه الطريقة لأنه hydroxylates المنشطات في موقف C21.[8] إنزيم يحفز التفاعل الكيميائي الذي يضاف فيه مجموعة الهيدروكسيل (-OH) في موقف C21 للجزيئات الحيوية الستيرويد. الإنزيم هو عضو من أعضاء عائلة السيتوكروم P450 الفائقة من إنزيمات مونوكسيجيناز . ال سيتوكروم P450 إنزيمات تحفيز العديد من ردود الفعل المشاركة في استقلاب المخدرات وتوليف الكولسترول، المنشطات والدهون الأخرى. 21-هيدروكسيلاز موضعي في ميكروسومات من أغشية شبكية إندوبلازمية داخل قشرة الغدة الكظرية . وهي واحدة من ثلاثة ميكروسومال الستيرويدية P450 الإنزيمات, الآخرين يجري 17-هيدروكسيلاس وأروماتيز.[11]
21-هيدروكسيلاس هو إنزيم أساسي في مسارات التركيب الحيوي التي تنتج الكورتيزول والدوستيرون .[12][13]
هيكل
21-هيدروكسيلاس هو مجمع من ثلاث وحدات فرعية انزيم مستقلة ومتطابقة. كل وحدة فرعية في الإنزيم البشري يتكون من 13 لولب α و 9 ß-صحيفة ، التي تشكلت في هيكل ثلاثي مثل المنشور الثالث .[7] تقع مجموعة الهيم الحديدية (III) التي تعرف الموقع النشط موجودة في مركز كل من الوحدات الفرعية. يربط الإنزيم البشري ركيزة واحدة في كل مرة. في المقابل ، يمكن أن يرتبط إنزيم الأبقار الذي يتميز بشكل جيد بركيزتين.[14] يشترك الإنزيم البشري والبقري بنسبة 80 ٪ في هوية تسلسل الأحماض الأمينية ، ولكنهما مختلفان هيكليًا ، لا سيما في مناطق الحلقة ، وأيضًا واضح في عناصر البنية الثانوية .
رد فعل
21-هيدروكسيلاز يحفز إضافة الهيدروكسيل (-OH) إلى موضع C21 لاثنين من المنشطات: البروجسترون و17 ألفا هيدروكسي بروجسترون. وقد وصف التفاعل هذا لأول مرة في عام 1952.[15]


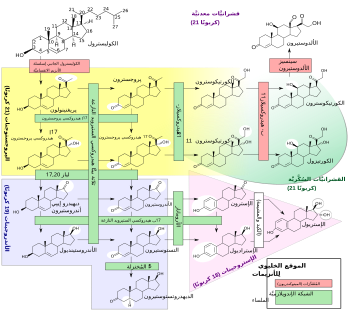

إنزيم 21-هيدروكسيلاس هو إنزيم P450 السيتوكروم ويتبع الدورة التحفيزية P450 .
يعد ٢١-هيدروكسيلاز خاصًا بدرجة عالية من أجل الهيدروكسيل (hydroxylation) من البروجسترون و ١٧-hydroxyprogesterone. هذا هو في تناقض واضح مع إنزيم P450 17-hydroxylase المرتبط وظيفيًا و تطوريًا ، و يحتوي على مجموعة واسعة من الركائز.[16]
دراسات سابقة من انزيم الإنسان أفصح عنها في الخميرة المصنفة 17-هيدروكسي بروغيسترون والركيزة المصفى ل 21-هيدروكسيلاس .[16][17][18] ، ومع ذلك، وجدت التحليلات الحديثة للأنزيم البشري المصفى أقل K M وكفاءة تحفيزية أكبر للبروجسترون فوق 17-هيدروكسي بروجستيرون.[7]
الكفاءة الحفازة لـ 21 هيدروكسيلاز لتحويل البروجسترون في البشر هو حوالي 1.3 × 10 ^ 7 M-1s-1 عند 37 درجة مئوية. وهذا يجعلها إنزيم P450 الأكثر كفاءة من تلك التي تم الإبلاغ عنها حتى الآن ، وأكثر كفاءة من الناحية الحفزية من إنزيم الأبقار 21-هيدروكسيلاس المرتبط بشكل وثيق.[9] C-H السندات كسر لخلق الكربون الجذري الأولي ويعتقد أن تكون خطوة تحد من معدل في الهيدروكسيل.[7]
مثل غيرها من الإنزيمات السيتوكروم P450، 21 هيدروكسيلاس يشارك في الدورة الحفازة السيتوكروم "cytochrome" P450 "ويشارك في نقل الإلكترون واحد مع NADPH-P450 reductase.هيكلها يتضمن مجموعة هيمي الحديد الأساسية التي تركز داخل البروتين، كما أنها مشتركة لجميع الإنزيمات P450. هيكلها يتضمن مجموعة هيمي الحديد الأساسية التي تركز داخل البروتين، كما أنها مشتركة لجميع الإنزيمات P450. يمكن العثور على أشكال مختلفة في إنزيم 21 هيدروكسيلاز في جميع الفقاريات .[19] ومع ذلك ، فإن فهم بنية الإنسان21 هيدروكسيلاز ووظيفته له قيمة سريرية خاصة ، كما فشل الإنزيم إلى العمل بشكل مناسب يؤدي إلى فرط تنسج الكظر الخلقي. تم تحقيق البنية البلورية للأشعة السينية لـ 21 هيدروكسيلاز البشري ، مع هرمون البروجسترون المقيد ، ونشرها في عام 2015 ، مما أتاح فرصة لمزيد من الدراسة.[7] الانزيم هو ملحوظ لخصوصيته الركيزة وكفاءة الحفاز عالية نسبيا.
جينات
علم الوراثة
An Error has occured retrieving Wikidata item for infoboxAn Error has occured retrieving Wikidata item for infoboxAn Error has occured retrieving Wikidata item for infobox
موقع
21-هيدروكسيلاس هو بروتين مشفر بواسطة جين CYP21A2 في البشر. يوجد جين كاذب موصول ، CYP21A1P بالقرب من هذا الجين.[20] وتقع كل الجينات على كروموسوم 6، في مركب التواؤم النسجي الرئيسي الثالث [21] من قرب عنصر يكمل 4 جينات C4A و C4B و Tenascin X TNXB الجينات، [22] وجين كاذب، CYP21A1P، ويحتفظ 98٪ exonic مع الجينات الوظيفية CYP21A2 .[23]
في جينوم الفأر ، CYP21A2 هو جين زائف وال CYP21A1 هو جين وظيفي.[24] وفي الدجاج والسمان ،لا يوجد سوى جين CYP21 واحد، والذي يقع بين مكون مكمل C4 وجين TNX، جنبا إلى جنب مع CENPA .[25]

دور في معقد التوافق النسيجي الرئيسي للإنسان
MHC class III هي مجموعة من البروتينات تنتمي إلى فئة معقد التوافق النسيجي الرئيسي (MHC).[21] على عكس أنواع MHC الأخرى مثل MHC class I وMHC class II ، والتي تم تحديد هيكلها ووظائفها في الاستجابة المناعية بشكل جيد ، MHC الفئة الثالثة هي سيئة المعالم هيكليا ووظيفيا. وهو يغطي 700 كيلوبايت ويحتوي على 61 جينات، مما يجعلها المنطقة الأكثر كثافة في الجينات من الجينوم البشري.[26] وظائف العديد من الجينات غير معروفة حتى الآن.
يسافر الجين CYP21A2 جنبًا إلى جنب مع الجين الكاذب ، CYP21P1 ، وتشير الدرجة العالية من تشابه التسلسل بينهما إلى أن هذين الجينين يتطوران جنبًا إلى جنب من خلال التبادل الجيني للحمض النووي.[27] يقع الجين CYP21A2 داخل مجموعة RCCX ، وهي المجموعة الجينية الأكثر تعقيدًا في الجينوم البشري.[28] نظراً لدرجة عالية من علم الهموم بين جين CYP21A2 و CYP21P1 pseudogene وتعقيد مكان، فمن الصعب دراسة الجين CYP21A2 على المستوى الجزيئي.[29]
الأهمية السريرية
تضخم الغدة الكظرية الخلقي
المتغيرات الجينية في جين CYP21A2 تسبب اضطرابا في تطور الانزيم، مما قد يؤدي إلى فرط التنسج الكظري الخلقي بسبب نقص 21-هيدروكسيلاس . يوجد جين زائف مرتبط بـ CYP21A1 بالقرب من هذا الجين. ويعتقد أن الأحداث تحويل المورث التي تنطوي على الجين الوظيفي والجين الكاذب لحساب العديد من الحالات من نقص الستيرويد 21-هيدروكسيلاس.[5] تضخم الغدة الكظرية الخلقي (CAH) ههو اضطراب متنحي ذات. هناك أشكال متعددة من CAH، مقسمة إلى أشكال الكلاسيكية وغير الكلاسيكية على أساس كمية الوظيفة المحتفظ بها. الأشكال الكلاسيكية يحدث في ما يقرب من 1 في 15000 ولادة على الصعيد العالمي، [30][31] وتشمل إهدار الملح (SW) ، والانتشار البسيط (SV). الطفرات التي تتداخل مع الموقع النشط - مجموعة الهيم أو المخلفات المشاركة في الربط الركيزي - تؤدي إلى فقدان كامل للنشاط الأنزيمي ، نوع إضاعة الملح.[32] أظهرت الدراسات أن الطفرات في بنية 21 هيدروكسيلاز ترتبط بالخطورة السريرية للتضخم الكظري الخلقي.[33] وترتبط الكولونيزول والدوستيرون العجز مع فقدان الملح الذي يهدد الحياة (ومن ثم هدر الملح), كما المنشطات تلعب أدوارا في تنظيم توازن الصوديوم . مع الحفاظ على الحد الأدنى من نشاط الإنزيم ، رتبط النوع البسيط الفيروسي مع الطفرات في المناطق المائية المحفوظة أو بالقرب من مجال الغشاء. و يحافظ مرضى تضخم الغدة الكظرية CAH الخلقي الفيروسي البسيط على توازن صوديوم كافية ، ولكن تظهر أعراض ظاهرية أخرى مشتركة من قبل SW ، بما في ذلك النمو المتسارع في مرحلة الطفولة والأعضاء التناسلية الغامضة لدى المواليد الإناث. تحتفظ الأشكال غير الكلاسيكية بنسبة 20-60٪ من وظيفة الهيدروكسيلاس - ويرتبط هذا النموذج بتعبير الكورتيزول العادي، ولكن فائض من الاندروجين بعد البلوغ.[34][35]
تضخم الغدة الكظرية الخلقي غير الكلاسيكي
يعتبر تضخم الغدة الكظرية الخلقي غغير الكلاسيكي الناجم عن نقص 21 هيدروكسيلاس (NCCAH) هو تضخم الغدة الكظرية الخلقي الأكثر اعتدالاً وتأخراً في الظهور. يتراوح معدل انتشاره في المجموعات العرقية المختلفة من 1: 1000 إلى 1:50.[13][36] ببعض الأشخاص المصابين بهذه الحالة ليس لديهم علامات وأعراض ذات صلة ، في حين يعاني آخرون من أعراض فرط الأندروجين . عادة ما يكون لدى النساء المصابات بـ NCCAH أعضاء تناسلية أنثوية طبيعية عند الولادة. في وقت لاحق من الحياة، قد تكون علامات وأعراض الحالة في النساء مختلفة، ولكن قد تشمل حب الشباب، والشعرانية ، والصلع الذكوري ، وعدم انتظام الدورة الشهرية ، والعقم.[37][38] وقد نشرت دراسات أقل عن الذكور مع NCCAH مقارنة بتلك المتعلقة بالإناث، لأن الذكور عموما لا يوجد لهم أعراض. قد يكون لدى الذكور نمو مبكر للحية وخصيتين صغيرتين نسبيًا. عادة ، لديهم عدد طبيعي من الحيوانات المنوية.
انظر أيضًا
- انزيم الستيرويد
- نقص أوكسيريدوكتاز السيتوكروم P450
المراجع
- ^ "Information on EC 1.14.14.16 - steroid 21-monooxygenase". مؤرشف من الأصل في 2020-10-11.
- ^ "Non-Classic Disorder of Adrenal Steroidogenesis and Clinical Dilemmas in 21-Hydroxylase Deficiency Combined with Backdoor Androgen Pathway. Mini-Review and Case Report". International Journal of Molecular Sciences. ج. 21 ع. 13: 4622. يونيو 2020. DOI:10.3390/ijms21134622. PMID:32610579.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Brain white matter impairment in congenital adrenal hyperplasia". Archives of Neurology. ج. 63 ع. 3: 413–6. مارس 2006. DOI:10.1001/archneur.63.3.413. PMID:16540460.
- ^ "Congenital adrenal hyperplasia conditioned by 21beta-hydroxylase deficiency - clinical considerations". Endokrynologia, Diabetologia i Choroby Przemiany Materii Wieku Rozwojowego (بpolski). 6 (1): 67–9. 2000. PMID:14640134.
- ^ أ ب "NCBI: CYP21A2 cytochrome P450 family 21 subfamily A member 2". National Center for Biotechnology Information. مؤرشف من الأصل في 2020-10-28. اطلع عليه بتاريخ 2020-11-30.
This gene encodes a member of the cytochrome P450 superfamily of enzymes. The cytochrome P450 proteins are monooxygenases which catalyze many reactions involved in drug metabolism and synthesis of cholesterol, steroids and other lipids. This protein localizes to the endoplasmic reticulum and hydroxylates steroids at the 21 position. Its activity is required for the synthesis of steroid hormones including cortisol and aldosterone. Mutations in this gene cause congenital adrenal hyperplasia. A related pseudogene is located near this gene; gene conversion events involving the functional gene and the pseudogene are thought to account for many cases of steroid 21-hydroxylase deficiency. Two transcript variants encoding different isoforms have been found for this gene.
 تتضمن هذه المقالة نصًا من هذا المصدر المُتاح في الملكية العامة.
تتضمن هذه المقالة نصًا من هذا المصدر المُتاح في الملكية العامة.
- ^ "Hydroxylation of steroids at carbon 21" (PDF). The Journal of Biological Chemistry. ج. 225 ع. 1: 103–14. مارس 1957. PMID:13416221. مؤرشف من الأصل (PDF) في 2020-03-25.
- ^ أ ب ت ث ج "Human Cytochrome P450 21A2, the Major Steroid 21-Hydroxylase: structure of the enzyme·progesterone substrate complex and rate-limiting c-h bond cleavage". The Journal of Biological Chemistry. ج. 290 ع. 21: 13128–43. مايو 2015. DOI:10.1074/jbc.M115.646307. PMID:25855791.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ أ ب "The steroid metabolite 16(β)-OH-androstenedione generated by CYP21A2 serves as a substrate for CYP19A1". The Journal of Steroid Biochemistry and Molecular Biology. ج. 167: 182–191. مارس 2017. DOI:10.1016/j.jsbmb.2017.01.002. PMID:28065637.
{{استشهاد بدورية محكمة}}: الوسيط|إظهار المؤلفين=6غير صالح (مساعدة) - ^ أ ب "Recent Structural Insights into Cytochrome P450 Function". Trends in Pharmacological Sciences. ج. 37 ع. 8: 625–40. أغسطس 2016. DOI:10.1016/j.tips.2016.05.006. PMID:27267697.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Mechanism of intermolecular interactions of microsomal cytochrome P450s CYP17 and CYP21 involved in steroid hormone biosynthesis". Biochemistry. Biokhimiia. ج. 77 ع. 6: 585–92. يونيو 2012. DOI:10.1134/S0006297912060041. PMID:22817457.
- ^ "P450 enzymes in steroid processing". Cytochrome P450: Structure, Mechanism, and Biochemistry (ط. Fourth). Springer International Publishing. 2015. ص. 851–879. DOI:10.1007/978-3-319-12108-6_12. ISBN:978-3-319-12107-9.
- ^ "Microconversion between CYP21A2 and CYP21A1P promoter regions causes the nonclassical form of 21-hydroxylase deficiency". The Journal of Clinical Endocrinology and Metabolism. ج. 92 ع. 10: 4028–34. أكتوبر 2007. DOI:10.1210/jc.2006-2163. PMID:17666484.
- ^ أ ب "Congenital Adrenal Hyperplasia Due to Steroid 21-Hydroxylase Deficiency: An Endocrine Society Clinical Practice Guideline". The Journal of Clinical Endocrinology and Metabolism. ج. 103 ع. 11: 4043–4088. نوفمبر 2018. DOI:10.1210/jc.2018-01865. PMID:30272171.
{{استشهاد بدورية محكمة}}: الوسيط|إظهار المؤلفين=6غير صالح (مساعدة) والوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Three-dimensional structure of steroid 21-hydroxylase (cytochrome P450 21A2) with two substrates reveals locations of disease-associated variants". The Journal of Biological Chemistry. ج. 287 ع. 13: 10613–22. مارس 2012. DOI:10.1074/jbc.M111.323501. PMID:22262854.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ Dorfman RI، Hayano M (مارس 1952). "The action of adrenal homogenates on progesterone, 17-hydroxyprogesterone and 21-desoxycortisone". Archives of Biochemistry and Biophysics. ج. 36 ع. 1: 237–9. DOI:10.1016/0003-9861(52)90397-4. PMID:14934270.
- ^ أ ب "The enantiomer of progesterone (ent-progesterone) is a competitive inhibitor of human cytochromes P450c17 and P450c21". Archives of Biochemistry and Biophysics. ج. 409 ع. 1: 134–44. يناير 2003. DOI:10.1016/s0003-9861(02)00491-5. PMID:12464252.
- ^ "Expression of a full-length cDNA encoding bovine adrenal cytochrome P450C21". Archives of Biochemistry and Biophysics. ج. 273 ع. 1: 79–88. أغسطس 1989. DOI:10.1016/0003-9861(89)90164-1. PMID:2502949.
- ^ "Expression and functional study of wild-type and mutant human cytochrome P450c21 in Saccharomyces cerevisiae". DNA and Cell Biology. ج. 10 ع. 3: 201–9. أبريل 1991. DOI:10.1089/dna.1991.10.201. PMID:1707279.
- ^ "Sequence alignments, variabilities, and vagaries". Methods in Enzymology. ج. 357: 15–28. 2002. DOI:10.1016/s0076-6879(02)57661-8. ISBN:9780121822606. PMID:12424893.
- ^ "CYP21A2 intronic variants causing 21-hydroxylase deficiency". Metabolism: Clinical and Experimental. ج. 71: 46–51. يونيو 2017. DOI:10.1016/j.metabol.2017.03.003. PMID:28521877.
- ^ أ ب "Molecular genetics of the human MHC complement gene cluster". Experimental and Clinical Immunogenetics. ج. 15 ع. 4: 213–30. 1999. DOI:10.1159/000019075. PMID:10072631.
- ^ "Two genes encoding steroid 21-hydroxylase are located near the genes encoding the fourth component of complement in man". Proceedings of the National Academy of Sciences of the United States of America. ج. 82 ع. 4: 1089–93. فبراير 1985. Bibcode:1985PNAS...82.1089W. DOI:10.1073/pnas.82.4.1089. PMID:2983330.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Complete nucleotide sequence of two steroid 21-hydroxylase genes tandemly arranged in human chromosome: a pseudogene and a genuine gene". Proceedings of the National Academy of Sciences of the United States of America. ج. 83 ع. 9: 2841–5. مايو 1986. Bibcode:1986PNAS...83.2841H. DOI:10.1073/pnas.83.9.2841. PMID:3486422.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Expression of murine 21-hydroxylase in mouse adrenal glands and in transfected Y1 adrenocortical tumor cells". Proceedings of the National Academy of Sciences of the United States of America. ج. 82 ع. 23: 7860–4. ديسمبر 1985. Bibcode:1985PNAS...82.7860P. DOI:10.1073/pnas.82.23.7860. PMID:2999780.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Comparative genomic analysis of two avian (quail and chicken) MHC regions". Journal of Immunology. ج. 172 ع. 11: 6751–63. يونيو 2004. DOI:10.4049/jimmunol.172.11.6751. PMID:15153492.
{{استشهاد بدورية محكمة}}: الوسيط|إظهار المؤلفين=6غير صالح (مساعدة) - ^ "Analysis of the gene-dense major histocompatibility complex class III region and its comparison to mouse". Genome Research. ج. 13 ع. 12: 2621–36. ديسمبر 2003. DOI:10.1101/gr.1736803. PMID:14656967.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Tenascin-X, Congenital Adrenal Hyperplasia, and the CAH-X Syndrome". Hormone Research in Paediatrics. ج. 89 ع. 5: 352–361. 2018. DOI:10.1159/000481911. PMID:29734195.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Genetic organization of the human MHC class III region". Frontiers in Bioscience: A Journal and Virtual Library. ج. 6: D914–26. أغسطس 2001. DOI:10.2741/milner. PMID:11487476.
- ^ "Molecular diagnosis of patients with congenital adrenal hyperplasia due to 21-hydroxylase deficiency". BMC Endocrine Disorders. ج. 20 ع. 1: 165. نوفمبر 2020. DOI:10.1186/s12902-020-00643-z. PMID:33168061.
- ^ "Steroid disorders in children: congenital adrenal hyperplasia and apparent mineralocorticoid excess". Proceedings of the National Academy of Sciences of the United States of America. ج. 96 ع. 22: 12790–7. أكتوبر 1999. Bibcode:1999PNAS...9612790N. DOI:10.1073/pnas.96.22.12790. PMID:10536001.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Results of screening 1.9 million Texas newborns for 21-hydroxylase-deficient congenital adrenal hyperplasia". Pediatrics. ج. 101 ع. 4 Pt 1: 583–90. 1998. DOI:10.1542/peds.101.4.583. PMID:9521938.
- ^ "Research Resource: Correlating Human Cytochrome P450 21A2 Crystal Structure and Phenotypes of Mutations in Congenital Adrenal Hyperplasia". Molecular Endocrinology. ج. 29 ع. 9: 1375–84. سبتمبر 2015. DOI:10.1210/ME.2015-1127. PMID:26172259.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Measuring the structural impact of mutations on cytochrome P450 21A2, the major steroid 21-hydroxylase related to congenital adrenal hyperplasia". Journal of Biomolecular Structure & Dynamics. ج. 38 ع. 5: 1425–1434. مارس 2020. DOI:10.1080/07391102.2019.1607560. PMID:30982438.
- ^ "The molecular biology, biochemistry, and physiology of human steroidogenesis and its disorders". Endocrine Reviews. ج. 32 ع. 1: 81–151. فبراير 2011. DOI:10.1210/er.2010-0013. PMID:21051590.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Structure-phenotype correlations of human CYP21A2 mutations in congenital adrenal hyperplasia". Proceedings of the National Academy of Sciences of the United States of America. ج. 110 ع. 7: 2605–10. فبراير 2013. Bibcode:2013PNAS..110.2605H. DOI:10.1073/pnas.1221133110. PMID:23359706.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Revisiting the prevalence of nonclassic congenital adrenal hyperplasia in US Ashkenazi Jews and Caucasians". Genetics in Medicine. ج. 19 ع. 11: 1276–1279. نوفمبر 2017. DOI:10.1038/gim.2017.46. PMID:28541281.
{{استشهاد بدورية محكمة}}: الوسيط|إظهار المؤلفين=6غير صالح (مساعدة) والوسيط غير المعروف|PMCID=تم تجاهله يقترح استخدام|pmc=(مساعدة) - ^ "Congenital Adrenal Hyperplasia Due to 21-Hydroxylase Deficiency". The New England Journal of Medicine. ج. 383 ع. 13: 1248–1261. سبتمبر 2020. DOI:10.1056/NEJMra1909786. PMID:32966723.
- ^ "Non-classic congenital adrenal hyperplasia due to 21-hydroxylase deficiency". مؤرشف من الأصل في 2020-11-11.
تتضمن هذه المقالة نصوصًا مترجمة من نصوص منقولة من المكتبة الوطنية الأمريكية للطب، والتي تعد ملكية عامة.