|
تضامنًا مع حق الشعب الفلسطيني |
رباعي نتريد رباعي الكبريت
| رباعي نتريد رباعي الكبريت | |
|---|---|
 |
 |
| أسماء أخرى | |
Tetrasulfur tetranitride |
|
| الخواص | |
| الصيغة الجزيئية | S4N4 |
| الكتلة المولية | 184.29 غ/مول |
| المظهر | صلب برتقالي |
| الكثافة | 2.22 غ/سم3 |
| نقطة الانصهار | 178 °س |
| نقطة الغليان | 185 °س |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
رباعي نتريد رباعي الكبريت هو مركب لاعضوي من الكبريت والنتروجين صيغته S4N4، ويوجد على شكل صلب بلوري ذي لون أصفر برتقالي. يعد هذا المركب واحداً من مركبات نتريدات الكبريت المتعددة.[1]
التحضير
يمكن أن يحضر المركب من تفاعل ثنائي كلوريد ثنائي الكبريت مع الأمونيا، كما حضر أول مرة سنة 1835؛[2] والتي جرى تطورها وتحسينها مع مرور الوقت.[3]
الخواص
يوجد المركب في الشروط القياسية على شكل صلب بلوري ذي لون أصفر برتقالي، وهو مستقر وثابت تجاه الهواء. ولكنه غير مستقر عند التسخين إذ يتفكك وفق المعادلة التالية:[4]
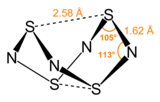
يتميز هذا المركب ببنيته المتميزة التي تشبه شكل القفص.[5]
الاستخدامات
يستخدم رباعي نتريد رباعي الكبريت مركباً طليعياً (سلف) للمركبات الحاوية على على رابطة S-N.[6]
يعطي تسخين هذا المركب بوليمراً لاعضوياً من متعدد الثيازيل SN)x)، والذي له خواص متميزة.[7][8][9]
طالع أيضاً
مراجع
- ^ Chivers، T. (2004). A Guide To Chalcogen-Nitrogen Chemistry. Singapore: World Scientific Publishing. ISBN:981-256-095-5.
- ^ Jolly، W. L.؛ Lipp، S. A. (1971). "Reaction of Tetrasulfur Tetranitride with Sulfuric Acid". Inorganic Chemistry. ج. 10 ع. 1: 33–38. DOI:10.1021/ic50095a008. مؤرشف من الأصل في 2020-05-06.
- ^ Villena-Blanco، M.؛ Jolly، W. L.؛ وآخرون (1967). S. Y. Tyree Jr (المحرر). "Tetrasulfur Tetranitride, S4N4". Inorganic Syntheses. ج. 9: 98–102. DOI:10.1002/9780470132401.ch26.
- ^ Greenwood، N. N.؛ Earnshaw، A. (1997). Chemical Elements (ط. 2nd). Boston, MA: Butterworth-Heinemann. ص. 721–725.
- ^ Sharma، B. D.؛ Donohue، J. (1963). "The Crystal and Molecular Structure of Sulfur Nitride, S4N4". Acta Crystallographica. ج. 16 ع. 9: 891–897. DOI:10.1107/S0365110X63002401.
- ^ Bojes، J.؛ Chivers، T.؛ Oakley، R. D.؛ وآخرون (1989). Allcock، H. R. (المحرر). "Binary Cyclic Nitrogen-Sulfur Anions". Inorganic Syntheses. ج. 25: 30–35. DOI:10.1002/9780470132562.ch7. ISBN:9780470132562.
- ^ N. N. Greenwood, A. Earnshaw: Chemical Elements. 2. Auflage. Butterworth-Heinemann, Boston, MA 1997, S. 721–725.
- ^ T. Chivers: Guide To Chalcogen-Nitrogen Chemistry. World Scientific Publishing Company, Singapore 2004, ISBN 981-256-095-5.
- ^ Greene، R. L.؛ Street، G. B.؛ Suter، L. J. (1975). "Superconductivity in Polysulfur Nitride (SN)x". Physical Review Letters. ج. 34 ع. 10: 577–579. Bibcode:1975PhRvL..34..577G. DOI:10.1103/PhysRevLett.34.577.
| رباعي نتريد رباعي الكبريت في المشاريع الشقيقة: | |