|
تضامنًا مع حق الشعب الفلسطيني |
بوران (مركب كيميائي)
| بوران (مركب كيميائي) | |
|---|---|
 |
 |
| الاسم النظامي (IUPAC) | |
borane |
|
| أسماء أخرى | |
borine |
|
| المعرفات | |
| رقم CAS | 13283-31-3 |
| بوب كيم (PubChem) | 6331 |
| الخواص | |
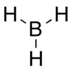
| الصيغة الجزيئية | BH3 |
| الكتلة المولية | 13.83 غ/مول |
| المظهر | غاز عديم اللون |
| الذوبانية في الماء | يتفكك |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
| تعديل مصدري - تعديل | |
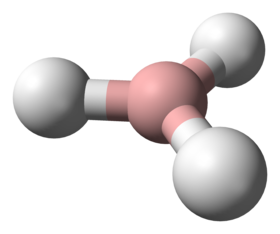
البوران (كما يسمى ثلاثي هيدريد البورون أو البورين) هو مركب لاعضوي له الصيغة BH3، ويكون على شكل غاز، لا يوجد بالشكل الحر إلا عند درجات حرارة مرتفعة أو في المحلول. في الشروط العادية يتحول البوران إلى ثنائي البوران B2H6. يعد البوران المركب الأساس لمجموعة من المركبات تدعى البورانات.
التحضير
يمكن تحضير البوران من التذرية الليزرية للبورون بوجود الهيدروجين، حيث يتشكل البوران كناتج ثانوي غازي إضافة إلى الناتج الرئيسي من ثنائي البوران B2H6 ومعقّد (BH(H2.[1]
الخصائص
إن للبوران BH3 بنية جزيئية مستوية ثلاثية (تناظر جزيئي من النمط D3h)، وذلك مع طول رابطة B–H مقاس تجريبياً مقداره 119 بيكومتر.[2]
إن الخاصة المميزة الرئيسية للبوران هي حدوث تفاعل ديمرة له وتشكيله لثنائي البوران، وهذا التفاعل ناشر للحرارة كما يظهر من المحتوى الحراري القياسي له -40 كيلوحريرة/مول.[3]
لا يشكل البوران محاليل مائية مستقرة بسبب حدوث تفاعل حلمهة:[4]
عند انحلال ثنائي البوران في ثنائي إيثيل الإيثر أو مضاعف (2-ميثوكسي إيثيل) الإيثر (ديغلايم) فإنه يوجد على شكل ثنائي وحدات (ديمر)، أما في رباعي هيدرو الفوران THF، فإنه يشكل ناتج إضافة 1:1 مع البوران THF.BH3.[5]
الاستخدامات
تستخدم نواتج إضافة البوران في الاصطناع العضوي من أجل إضافة البورون الهيدروجينية، حيث يضاف BH3 إلى الرابطة المضاعفة C=C في الألكينات لتعطي ثلاثي ألكيل البورانات:
هذا التفاعل له انتقائية فراغية، ويمكن تحويل مركبات ثلاثي ألكيل البورانات الناتجة إلى مشتقات عضوية مفيدة.
المراجع
- ^ Tague، Thomas J.؛ Andrews، Lester (1994). "Reactions of Pulsed-Laser Evaporated Boron Atoms with Hydrogen. Infrared Spectra of Boron Hydride Intermediate Species in Solid Argon". Journal of the American Chemical Society. ج. 116 ع. 11: 4970–4976. DOI:10.1021/ja00090a048. ISSN:0002-7863.
- ^ Kawaguchi، Kentarou (1992). "Fourier transform infrared spectroscopy of the BH3 ν3 band". The Journal of Chemical Physics. ج. 96 ع. 5: 3411. DOI:10.1063/1.461942. ISSN:0021-9606.
- ^ M. Page, G.F. Adams, J.S. Binkley, C.F. Melius "Dimerization energy of borane" J. Phys. Chem. 1987, vol. 91, pp 2675–2678. دُوِي:10.1021/j100295a001
- ^ d'Ulivo، Alessandro (مايو 2010). "Mechanism of generation of volatile species by aqueous boranes: Towards the clarification of most controversial aspects". Spectrochimica Acta Part B: Atomic Spectroscopy. Elsevier. ج. 65 ع. 5: 360–375. DOI:10.1016/j.sab.2010.04.010.
- ^ Brown، H. C.؛ Chandrasekharan، J.؛ Wang، K. K. (1983). "Hydroboration-kinetics and mechanism". Pure and Applied Chemistry. ج. 55 ع. 9: 1387–1414. DOI:10.1351/pac198355091387. ISSN:0033-4545.
| بوران في المشاريع الشقيقة: | |